Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
HalbäquivalenzpunktDer Halbäquivalenzpunkt bei einer Säure-Base-Titration ist der Punkt, bei dem man die Hälfte einer bestimmten Stoffmenge Säure mit der entsprechenden Stoffmenge Base neutralisiert hat, die zur vollständigen Neutralisation geführt hätte. Produkt-HighlightDer Halbäquivalenzpunkt ist bei schwachen Säuren gleich dem pKs-Wert der Säure. Umgekehrt gilt dies für schwache Basen und deren pKb-Wert. ErklärungDa eine schwache Säure in einer Lösung fast vollständig unprotolysiert vorliegt, erreicht man durch die Zugabe von der Hälfte an Base, die zur vollständigen Neutralisation führen würde, folgendes Gleichgewicht:
Hierbei ist HA eine allgemeine schwache Säure und A- eine allgemeine starke Base. Unter Zuhilfenahme der Henderson-Hasselbalch-Gleichung lässt sich also folgendes ableiten:
Durch das Gleichgewicht ergibt sich dann:
Da log10(1) gleich 0 ist kommt man zu dem Schluss:
Kategorien: Analytische Chemie | Säure-Base-Reaktion |
| Dieser Artikel basiert auf dem Artikel Halbäquivalenzpunkt aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





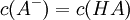
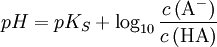
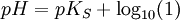
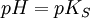 (für schwache Säuren)
(für schwache Säuren)


