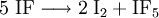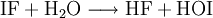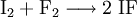Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Iodfluorid
Iodfluorid ist eine bei Raumtemperatur instabile Interhalogenverbindung aus den Elementen Iod und Fluor. Produkt-Highlight
EigenschaftenIodfluorid ist ein weißes Pulver und stabil bei Temperaturen unterhalb von −78 °C; oberhalb −14 °C disproportioniert die Verbindung in elementares Iod (I2) und Iodpentafluorid (IF5), eine gelbe Flüssigkeit: Mit Wasser reagiert Iodfluorid, analog zu allen anderen Interhalogenverbindungen, unter Bildung von Halogenwasserstoff, in diesem Fall Fluorwasserstoff (HF), und Hypohalogeniger Säure, in diesem Fall Hypoiodige Säure (HOI): Iodfluorid ist, in Analogie zu stabileren Interhalogenverbindungen, als giftig einzustufen. Es neigt von allen Interhalogenen am stärksten zum Zerfall, dies bereits bei sehr tiefen Temperaturen. Daher ist eine genaue Bestimmung der physikalischen Eigenschaften nicht möglich. DarstellungIodfluorid kann bei tiefen Temperaturen aus den Elementen dargestellt werden: Die direkte Umsetzung der Elemente führt jedoch unter weiterführender Fluorierung des Iodfluorids leicht zum Iodtrifluorid. Es kann praktisch nicht rein hergestellt werden und der Nachweis der Verbindung ist sehr schwierig. Deshalb sind auch die meisten Eigenschaften unbekannt. Womöglich ist es polymer. Siehe auch
Literatur
WeblinkSevim Hoyer, Strukturchemie von Iodverbindungen in den Oxidationsstufen +1/7 bis +5, Dissertation an der FU Berlin Kategorien: Iodverbindung | Fluorverbindung |
|||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodfluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||