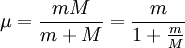Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Rydberg-KonstanteDie Rydberg-Konstante R∞ ist eine nach Johannes Rydberg benannte, in der Quantenmechanik verwendete Naturkonstante. Ihr derzeit allgemein empfohlener Wert beträgt nach CODATA 2006[1][2]
Produkt-HighlightSie kann demnach auf eine relative Standardabweichung von 0,0066 × 10-9 genau angegeben werden und ist damit die am genauesten messbare Naturkonstante überhaupt. Sie ergibt sich aus der Feinstrukturkonstante α und der Compton-Wellenlänge eines Elektrons, λC,e nach Die Wellenlängen der Spektrallinien von Atomen können anhand der Formel bestimmt werden. Dabei ist Z die Anzahl der Protonen im Kern (für Wasserstoff ist Z=1) und λ die Wellenlänge des vom Elektron emittierten Photons. Weiter bezeichnet n1 die Quantenzahl des Orbits, von dem aus das Elektron in den tiefergelegenen Orbit n2 übergeht - also etwa vom dritten Orbit n1=3 in den zweiten n2=2. Häufig werden auch Rydberg Frequenz R und die Rydberg Energie Ry als Rydberg-Konstante angegeben. Diese betragen
Letzteres ist gerade die Ionisierungsenergie des Wasserstoffs und wird ein Rydberg der Energie genannt. Die Wellenlänge ist nicht nur von der Rydberg-Konstante und der Kernladung, sondern auch von der Kernmasse M abhängig. Für jedes Isotop eines Elements kann die Wellenlänge aus für (Z-1)-fach geladene Kerne mit einem Elektron nach einer analogen Formel berechnet werden.
HerleitungDie Rydberg-Konstante lässt sich über die Bohrsche Bedingung, die Zentrifugalkraft, die Coulombkraft, und die elektrische potenzielle Energie eines Elektrons im Orbit um ein Proton berechnen.
Mit der Beziehung von de Broglie
Für eine stabile Bahn gilt klassisch
Nach Einsetzen von (1) in diese Beziehung ergibt sich für den Radius
Unter den gemachten Annahmen sind dies also einzigen erlaubten Radien für ein sich um ein Proton bewegendes Elektron. Außerdem folgt aus (2) für die Geschwindigkeit
Wenn wir mit (3) und (4) die Gesamtenergie berechnen, finden wir Jeder Orbit besitzt demnach eine bestimmte potenzielle und kinetische Energie, sodass bei einer Änderung des Orbits von n1 nach n2 auch eine Energieänderung stattfindet. Diese Änderung ist gerade Oder mit als Wellenlängenänderung geschrieben
Da hier ein e2 die Ladung des Kerns repräsentiert, muss für allgemeine Atome die Kernladungszahl Z hinzugefügt werden. Damit gilt
Die Rydberg-Konstante von Wasserstoff ist daher gerade
Dieses Ergebnis wurde erstmals von Niels Bohr als Folgerung seines Atommodells bestimmt. Für den genauen Wert von R bzw. der Energieniveaus des Wasserstoffs muss die Mitbewegung des Kerns berücksichtigt werden, weshalb die Elektronenmasse durch die reduzierte Masse µ ersetzt wird.
Quellen
Siehe auchPhysikalische Konstanten Kategorien: Atomphysik | Quantenphysik |
| Dieser Artikel basiert auf dem Artikel Rydberg-Konstante aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





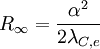
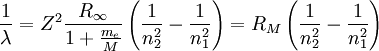
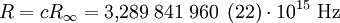
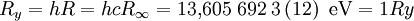
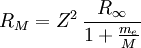
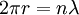
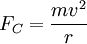
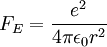
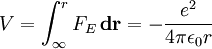
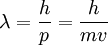 erhalten wir aus der Bohrschen Bedingung
erhalten wir aus der Bohrschen Bedingung
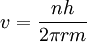 (1)
(1)
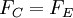
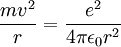 (2)
(2)
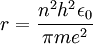 (3)
(3)
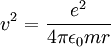 (4)
(4)
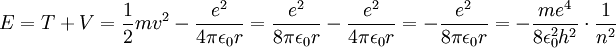
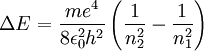
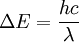
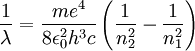 .
.
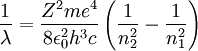 .
.
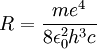 .
.
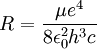 , mit
, mit