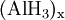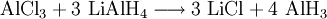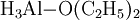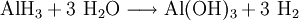Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Aluminiumhydrid
Aluminiumhydrid, Summenformel (AlH3)x, ist ein farbloses Pulver, welches oberhalb von 100 °C in seine Bestandteile zerfällt. Aluminiumhydrid ist außerordentlich feuchtigkeits- und oxidationsempfindlich. Es verbrennt explosionsartig an Luft und kann zur Speicherung von Wasserstoff in wasserstoffbetriebenen Fahrzeugen eingesetzt werden. Von Aluminiumhydrid kennt man fünf kristalline Phasen (α, γ, δ, ζ), von denen bislang nur die Struktur der α-Phase erforscht wurde. Durch Einbau von 0,01 bis 3 Gewichtsprozent Magnesium kann die Vakuumstabilität von α-Aluminiumhydrid signifikant erhöht werden.[3] Auch kann die Beständigkeit gegenüber Hydrolyse durch Tempern erhöht werden.[4] So behandeltes α-Aluminiumhydrid wird zur Zeit intensiv als energetischer Zusatz für Raketentreibstoffe und Sprengstoffe untersucht.[5] Weiteres empfehlenswertes FachwissenSyntheseDie Darstellung von Aluminiumhydrid erfolgt zweckmäßig durch die Umsetzung von Aluminiumchlorid mit Lithiumalanat: Hierbei wird zunächst eine als Monomer anfallende Verbindung, das Etherat: gebildet, welche sich allmählich in das hochpolymere Aluminiumhydrid umwandelt. ReaktionsverhaltenAluminiumhydrid reagiert mit Wasser sehr stark unter Wasserstoff-Freisetzung gemäß: Zusammen mit anderen Metallhydriden bildet Aluminiumhydrid Alanate Quellen
Kategorien: Feuergefährlicher Stoff | Aluminiumverbindung | Hydrid |
||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Aluminiumhydrid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||