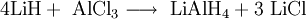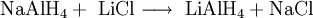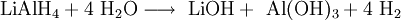Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Lithiumaluminiumhydrid
Lithiumaluminiumhydrid ist ein anorganisches Reduktionsmittel der Summenformel LiAlH4. Produkt-Highlight
SyntheseMan suspendiert unter Schutzgas und Kühlung 4 Teile Lithiumhydrid und 1 Teil Aluminiumchlorid in wasser- und peroxidfreiem Diethylether. Anschließend filtriert man das ausgefallene Lithiumchlorid ab. Durch Abdampfen des Ethers im Vakuum bleibt pulverförmiges Lithiumaluminiumhydrid zurück.
In der Technik wird es durch Umsetzen von Natriumaluminiumhydrid mit Lithiumchlorid hergestellt. ReaktionsverhaltenLithiumaluminiumhydrid ist ein starkes Reduktionsmittel und reduziert selektiv fast alle Kohlenstoff-heteroatom-doppelbindungen wie beispielsweise C=O, C=N usw., es schont dagegen C-C-Doppelbindungen. Es reduziert Nitroverbindungen zu primären Aminen, Carbonylverbindungen zu Alkoholen, Carbonsäuren, Ester, Säurechloride und Säureanhydride zu primären Alkoholen. VerwendungLithiumaluminiumhydrid wird, wie auch Natriumborhydrid, in der Organischen Chemie als Reduktionsmittel verwendet. In Verbindung mit chiralen Reagenzien, z.B. TADDOL, ist es möglich enantioselektive Reduktionen von Ketonen vorzunehmen. QuellenKategorien: Feuergefährlicher Stoff | Lithiumverbindung | Aluminiumverbindung | Hydrid |
|||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Lithiumaluminiumhydrid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||