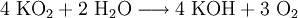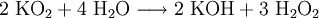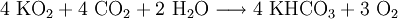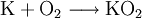Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kaliumhyperoxid
Kaliumhyperoxid oder Kaliumsuperoxid (KO2) ist eine gelbe, salzartige chemische Verbindung und zählt zu den Hyperoxiden. Weiteres empfehlenswertes Fachwissen
Eigenschaften und VerwendungDas gelbe Salz zersetzt sich in Wasser lebhaft unter Bildung von Kalilauge, Wasserstoffperoxid und Sauerstoff.
Kaliumhyperoxid besitzt die Fähigkeit Wasserdampf und Kohlenstoffdioxid zu binden und dafür Sauerstoff an die Umgebung abzugeben.
Da sowohl Kohlenstoffdioxid als auch Wasser bei der Atmung abgegeben werden, kann es deshalb beispielsweise in Raumstationen, U-Booten oder in Atemrettungsgeräten zur Regenerierung der Atemluft verwendet werden. Neben Kaliumhyperoxid wird zum Austausch von Kohlenstoffdioxid gegen Sauerstoff auch Natriumperoxid (Na2O2) benutzt. Ein Vorteil von Natriumperoxid gegenüber Kaliumhyperoxid ist das geringere Gewicht. HerstellungKaliumhyperoxid wird durch Erhitzen von Kalium im Sauerstoffstrom oder in sauerstoffangereicherter Luft hergestellt. Es bildet sich allerdings auch nach folgender Reaktionsgleichung bei der Verbrennung von Kalium an der Luft unter Atmosphärendruck:
QuellenLinks"Oxide, Peroxide, Hyperoxide und Ozonide der Alkalimetalle: Herstellung, Struktur, Bedeutung" http://www.uni-bayreuth.de/departments/ddchemie/umat/alkalimet_overb/alkalimet_overb.htm Kategorien: Brandfördernder Stoff | Ätzender Stoff | Sauerstoffverbindung | Kaliumverbindung |
||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kaliumhyperoxid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||