Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
LöslichkeitDie Löslichkeit eines Stoffes gibt an, ob und in welchem Umfang ein Reinstoff in einem Lösungsmittel gelöst werden kann. Sie bezeichnet also die Eigenschaft eines Stoffes, sich unter homogener Verteilung (als Atome, Moleküle oder Ionen) mit dem Lösungsmittel zu vermischen. Meist ist das Lösungsmittel eine Flüssigkeit. Es gibt aber auch feste Lösungen, wie etwa Legierungen, Gläser, keramische Werkstoffe und dotierte Halbleiter. Bei der Lösung von Gasen in Flüssigkeiten bezeichnet der Begriff Löslichkeit einen Koeffizienten, der die im Diffusionsgleichgewicht mit dem Gasraum in der Flüssigkeit gelöste Gasmenge bezogen auf den Druck des Gases angibt. Man unterscheidet die
Produkt-Highlight
Qualitative LöslichkeitHeute weiß man, dass es bei Temperaturen über dem absoluten Nullpunkt allein aus thermodynamischen Gründen (Entropie) für jeden Stoff in jedem anderen Stoff immer eine gewisse Löslichkeit geben muss. Die immer genauer werdenden Analysemethode bestätigen das. Deshalb kann streng genommen eine Unterscheidung zwischen löslich und unlöslich nicht getroffen werden. Es handelt sich also um semiquantitative Feststellungen wie schwer löslich, begrenzt löslich oder unbegrenzt löslich. In welchen Flüssigkeiten ein Feststoff gut löslich ist, hängt von den molekularen Eigenschaften des Stoffes und der Flüssigkeit ab. So sind salzartige Stoffe (Ionen-Verbindungen) fast nur in polaren Lösungsmitteln wie Wasser oder auch Fluorwasserstoff (HF) löslich. Viele lipophile, z. B. wachsartige, Stoffe sind dagegen nur in organischen Lösungsmitteln wie Benzin (ein „apolares“ Lösungsmittel) nennenswert löslich. „Polar“ bedeutet in diesem Zusammenhang, dass die Moleküle des Lösungsmittels ein Dipolmoment aufweisen und deshalb mit geladenen (Ionen) oder ihrerseits polaren Molekülen der zu lösenden Substanz in Wechselwirkung treten, jedoch ohne dass es zu einer Reaktion kommt. Die Polarität von Lösungsmitteln ist skalierbar. Unterschiedliche Polaritäten und damit unterschiedliche Löslichkeiten werden in Chromatografie-Verfahren ausgiebig genutzt. Viele Substanzen, wie zum Beispiel Ethanol sind sowohl mit Wasser als auch mit unpolaren Lösungsmitteln gut mischbar. Aceton ist mit fast jeder Flüssigkeit mischbar. Quantitative LöslichkeitDie Löslichkeit eines Stoffes in einem Lösungsmittel ist nicht in allen Fällen begrenzt. So ist Schwefelsäure mit Wasser in einem beliebigen Verhältnis mischbar. Bei der Mischung von Phenol mit Wasser gibt es dagegen zwei Bereiche: eine Lösung von Phenol in Wasser und eine Lösung von Wasser in Phenol. Dazwischen bleibt ein Bereich „verbotener“ Mischungsverhältnisse ausgespart, der zur Ausbildung einer Schichtung von zwei flüssigen Phasen führt. Die quantitative Löslichkeit oder Löslichkeitsgrenze gibt bei begrenzt löslichen Systemen die maximale Konzentration des einen Stoffes in dem anderen an, in dem das Gemisch unter Gleichgewichtsbedingungen noch einphasig ist. Die Löslichkeitsgrenze ist temperaturabhängig. Wird die Löslichkeitsgrenze überschritten, so scheidet sich eine zweite Phase aus. Fehlt die nötige Aktivierungsenergie oder Diffusion für das Ausscheiden der zweiten Phase, so bleibt das Gemisch auch überhalb der Löslichkeitsgrenze einphasig in einem metastabilen, übersättigten Zustand. Bei Salzen folgt die Löslichkeit aus dem Löslichkeitsprodukt. Liegt keines der beteiligten Ionen zusätzlich aus einer anderen Quelle vor, kann die Löslichkeit des betreffenden Salzes berechnet werden: Die Löslichkeit des Salzes AmBn: In gemischten Lösungen, wie in z. B. natürlichen Wässern, kommt es regelmäßig vor, dass die Konzentrationen von Anionen und Kationen nicht stöchiometrisch paarweise übereinstimmen, wie es der Lösung einzelner Salze entspräche. Ein wichtiges Beispiel hierfür ist der gelöste Kalk, der durch gelöstes Kohlenstoffdioxid als Calciumhydrogencarbonat in Lösung geht und den wesentlichen Beitrag zur Wasserhärte bildet. Über das Dissoziationsgleichgewicht der Kohlensäure verschieben sich mit den ständig wechselnden Kohlenstoffdioxid-Gehalten des Wassers (z. B. durch Atmung und Photosynthese der Wasserorganismen) auch die Konzentrationen der Carbonat- und Hydrogencarbonat-Anionen, während die Konzentration der Calcium-Kationen davon zunächst unberührt bleibt. In diesem Fall entscheidet das Produkt aus den durchaus nicht äquivalenten Konzentrationen an Calcium- und Carbonat-Ionen darüber, ob und in welchem Umfang es wegen einer Überschreitung des Löslichkeitsproduktes zu einer Ausfällung von Calciumcarbonat (z. B. als Kesselstein oder Seekreide) kommt. Die quantitative Löslichkeit wird, wie allgemein die Konzentration von Lösungen, in verschiedenen Einheiten angegeben:
Beispiel für die Löslichkeitsberechnung eines EinzelsalzesBerechnung der Löslichkeit L für Aluminiumsulfat in Wasser, bei bekanntem KL Das heißt: aus jedem Mol Aluminiumsulfat entstehen in der Lösung 2 Mol Aluminium- und 3 Mol Sulfationen. Weiterhin gilt folgender Zusammenhang zwischen Reaktionskonstante KL und der Löslichkeit L: Die Faktoren vor L erklären sich durch den Stöchiometrischen Faktor. damit Die Zahlenwerte für die Löslichkeitsprodukte erhält man aus den freien Standard-Enthalpien (s. Gibbs Energie). Lösung von Gasen in FlüssigkeitenAn der Grenzfläche zwischen Gasen und Flüssigkeiten kommt es zur Diffusion von Gasmolekülen zwischen dem Gasraum und dem Lösungsraum. Dabei ist der Eintritt von Molekülen in die Lösung proportional dem Partialdruck des Gases und der Austritt proportional der Konzentration des Gases in der Lösung (siehe Henry-Gesetz). Bei der sog. Sättigungskonzentration herrscht ein dynamisches Gleichgewicht zwischen beiden Diffusionsrichtungen. Die Sättigungskonzentration ist proportional zum Partialdruck im Gasraum. Die verbindende Proportionalitätskonstante wird hier als Löslichkeit bezeichnet: Gaslöslichkeit (Gas i) = Sättigungskonzentration(i) / Partialdruck(i) In der Regel nimmt diese Löslichkeit von Gasen in Flüssigkeiten mit steigender Temperatur ab. Eine Abweichung von der Proportionalität zwischen Gasdruck und Gleichgewichtskonzentration macht sich erst bei hohen Drücken bemerkbar. Lösung von Metallen in MetallenIm normalen Sprachgebrauch stellt man sich unter Lösungen meist flüssige Medien vor, aber es gibt (bei Raumtemperatur) auch feste Lösungen z. B. die Legierungen, also Lösungen von Metallen in Metallen. Sie sind verbreitet wegen ihrer besonderen Werkstoff-Eigenschaften im Einsatz. Bronze ist die älteste von Menschen bewusst hergestellte Legierung. Messing und die verschiedenen Stähle sind bekannte Beispiele. Auch Schmuckgold ist meist eine Legierung von Gold mit Silber (Gelbgold) oder Kupfer (Rotgold), deren Goldanteil in Karat angegeben wird. Siehe auch |
|
| Dieser Artikel basiert auf dem Artikel Löslichkeit aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





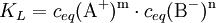
![L = \frac{c_{eq}\mathrm(A^+)}{m} = \frac{c_{eq}\mathrm(B^-)}{n} = \sqrt[n+m]{\frac{K_L}{n^n \cdot m^m}}](images/math/0/d/f/0dfd4659a87645adabca9850e7417249.png)
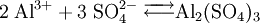
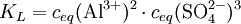
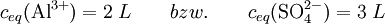
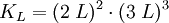
![L = \sqrt[5]{\frac{K_L}{2^2\cdot3^3}}](images/math/7/0/3/703125d17ef4d4542d06d027c9f784f8.png)


