Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Abschirmung (Atomphysik)Abschirmung ist die Verringerung der anziehenden Wechselwirkung zwischen einem Elektron und dem Atomkern durch die Wirkung der übrigen Elektronen in einem Mehrelektronenatom. Die Energie Produkt-Highlight
Wobei e Ladung, Z Kernladungszahl,
Für n' gilt in Abhängigkeit von n:
Die Einelektronenfunktionen |
||||||||||||||
| Dieser Artikel basiert auf dem Artikel Abschirmung_(Atomphysik) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


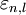 eines
eines 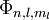 wurden von
wurden von 


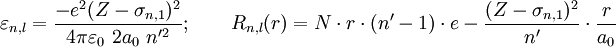
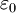 elektrische Feldkonstante,
elektrische Feldkonstante, 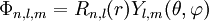 , die mit den obigen Regeln ermittelten Radialteilchen, heißen Slater-
, die mit den obigen Regeln ermittelten Radialteilchen, heißen Slater-

