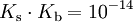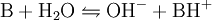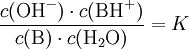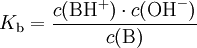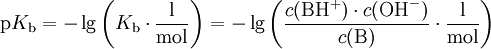Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
BasenkonstanteDie Basenkonstante (Kb) ist eine Größe, welche angibt, in welchem Maße eine Base in einem Lösungsmittel alkalisch reagiert. Sie wird eher selten verwendet, da sie sich direkt aus der → Säurekonstante Ks berechnen lässt. Für in Wasser gelöste Säuren und Basen gilt dabei folgende Beziehung: Produkt-HighlightSäure-Base-ReaktionZwischen einer Base B und ihrer Säure BH + liegt in wässriger Lösung folgende Gleichgewichtsreaktion vor: Nach dem Massenwirkungsgesetz wird die Lage des Gleichgewichtes durch die Gleichgewichtskonstante K beschrieben: Da die Konzentration von Wasser c(H2O) bei der Reaktion praktisch konstant bleibt, lässt sich c(H2O) in die Konstante K einbeziehen. Damit ergibt sich schließlich die Basenkonstante Kb: Häufig wird der negative dekadische Logarithmus von Kb, der sogenannte pKb-Wert, angegeben: Kategorien: Chemische Größe | Säure-Base-Reaktion |
| Dieser Artikel basiert auf dem Artikel Basenkonstante aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |