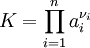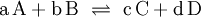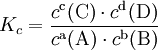Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
MassenwirkungsgesetzDas Massenwirkungsgesetz (oder kurz „MWG“) gibt einen Zusammenhang zwischen den Aktivitäten der Edukte und der Produkte einer (chemischen) Reaktion im chemischen Gleichgewicht wieder. Es gilt für jede Reaktion, die reversibel ist und bereits ihren Gleichgewichtszustand erreicht hat. Die resultierende Konstante hat unter gegebenen Bedingungen einen festen, für die betrachtete Reaktion spezifischen Wert, auf den kein anderer Einfluss als die Möglichkeit zur Änderung der äußeren Bedingungen besteht. Die thermodynamisch einfachste Erklärung hierfür ist, dass es immer einen energetisch niedrigsten und damit günstigsten Zustand gibt. Die Reaktion kommt im chemischen Gleichgewicht keineswegs zum Stillstand. Hinreaktion und Rückreaktion laufen nur gleich schnell ab. Mit dem MWG lassen sich viele Dinge und Größen erklären, die in Chemie und täglichem Leben wichtig sind (siehe unten). Produkt-Highlight
Exakte FormulierungDie allgemeine Formulierung lautet: Hierbei sind :
Die Gleichgewichtskonstante K gibt die Lage des Gleichgewichts an, beschreibt also, auf wieviele Produktmoleküle wieviele Eduktmoleküle kommen. Statt mit der Aktivität wird das Massenwirkungsgesetz häufig mit der Konzentration (in Lösung), dem Partialdruck (Reaktionen in der Gasphase) oder dem Stoffmengenanteil aufgestellt, wodurch sich im Allgemeinen der Zahlenwert von K ändert. Das Massenwirkungsgesetz kann auch durch eine Kombination dieser Größen (Druck, Konzentration ...) ausgedrückt werden. Zur Unterscheidung fügt man im Index von K die Angabe der Größe, mithilfe derer K berechnet wurde (Kc für Konzentration, Kp für den Partialdruck, Kx für den Stoffmengenanteil), hinzu. Die verschiedenen Ks lassen sich durch einfache Beziehungen ineinander umrechnen. Für Reaktionen in verdünnter Lösung wird normalerweise die Konzentration benutzt. Für konzentriertere Lösungen kann der Aktivitätskoeffizient jedoch stark von 1 abweichen, so dass diese Näherung mit Vorsicht zu verwenden ist. So wird zum Beispiel das Massenwirkungsgesetz für die Reaktion: wie folgt formuliert:
Dabei sind c(A), c(B), c(C), c(D) die molaren Gleichgewichtskonzentrationen der Edukte bzw. Produkte. Sie werden auch häufig als [A], [B], [C] und [D] notiert. Im Exponenten finden sich die stöchiometrischen Koeffizienten, also die Anzahl der Teilchen dieser Spezies, die für einen Formelumsatz benötigt werden. Eine exakte Herleitung des Gesetzes, die ohne Kenntnis des Reaktionsweges möglich ist, erfolgt in der Thermodynamik mit Hilfe des chemischen Potentials. Das Massenwirkungsgesetz wurde zuerst im Jahre 1864 von den norwegischen Chemikern Cato Maximilian Guldberg und Peter Waage formuliert; Es ist jedoch unter Guldberg 1867 angegeben. Sie hatten das Massenwirkungsgesetz noch aus der so genannten „aktiven Masse“ hergeleitet (ein veralterter Ausdruck für die Aktivität) statt aus der Konzentration. Verständnis des MWGHier einige der zu beachtenden Punkte:
Verwandte Größen und Prinzipien
Literatur
Prof. Blumes Massenwirkungsgestz (MGW) - ausführliche Beispiele und Herleitungen |
|||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Massenwirkungsgesetz aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |