Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
BindungsordnungDie Bindungsordnung bezeichnet die Zahl der effektiven Bindungen in einem Molekül. Sie ist definiert als die Hälfte der Zahl, die sich aus der Differenz von bindenden und antibindenen Valenzelektronen (in den Molekülorbitalen) ergibt. Produkt-HighlightBeispielsweise ist die Bindungsordnung im O2-Molekül: Elektronenkonfiguration des Sauerstoffs: 1s2,2s2,2p4 An der Bindung beteiligt sind 2s2- und 2p4-Molekülorbitale. In der Bindung bilden die 2s2 Orbitale ein bindendes und antibindendes σ − MO (Sigmamolekülorbital) aus, die jeweils mit 2 Elektronen besetzt sind. Die 2p4-Orbitale bilden ein bindendes σ − MO und 2 π − MO mit je 2 Elektronen aus. Die übrigen 2 Elektronen besetzten jeweils ein antibindendes π − Orbital. Daraus ergibt sich eine Bindungsordnung von siehe: Molekülorbital Link zu "bindend und antibindend": http://www.chemieplanet.de/stoffe/orbital.htm |
| Dieser Artikel basiert auf dem Artikel Bindungsordnung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





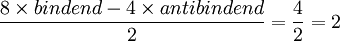 .
.


