Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Molekülorbitaltheorie
Das VB-Verfahren geht von lokalisierten Bindungen aus (siehe Valenzstrukturtheorie). Es stellt eine Erweiterung des Verfahrens dar, mit dem Walter Heitler und Fritz London 1927 das erste Mal das H2-Molekül näherungsweise berechnen konnten und so die Quantenchemie begründeten. Etwas später wurde von Friedrich Hund und Robert S. Mulliken das MO-Verfahren entwickelt, das heute für die meisten quantenchemischen Rechnungen verwendet wird. Produkt-Highlight
Physikalische ErklärungEine n-Elektronen-Wellenfunktion hat, wenn der Spin nicht beachtet wird, die allgemeine Form Die wahre Wellenfunktion lässt sich analytisch nicht finden. Eine zielführende Vereinfachung ist es, die Elektronen als statistisch unabhängig anzusehen. Mathematisch bedeutet das, einen Produktansatz zu verwenden Die aus MOs zusammengesetzte Funktion bleibt auch bei noch so guter Rechnung eine Näherung. Die Differenz zur wahren Energie wird Korrelationsenergie genannt. Abgesehen davon, dass MO-Schemata im allgemeinen nicht die wahre Situation wiedergeben können, ist zu beachten, dass sie in der MO-Theorie nicht eindeutig bestimmt sind. Entscheidend ist nur die Summe über alle quadrierten Orbitale, die Elektronendichte (das ist auch die Grundlage für die Dichtefunktionaltheorie). Mathematisch gesprochen ist die Wellenfunktion gegenüber einer unitären Lineartransformation invariant. Ein Beispiel dazu sind die beiden angegebenen Modelle zur Beschreibung der Doppelbindung. Mathematische GrundlagenGesucht werden Lösungen der Schrödingergleichung eines Moleküls. Die Rechnungen sind aber wesentlich schwieriger auszuführen als bei einem isolierten Atom. Im Normalfall, wenn mehr als ein Elektron betrachtet wird, gibt es im Sinne eines Dreikörperproblems keine analytisch angebbaren exakten Lösungen. Daher müssen Näherungsmethoden herangezogen werden. Dafür eignen sich das VB-Verfahren und das MO-Verfahren, die zu ähnlichen Ergebnissen führen. Zur näherungsweisen Bestimmung der Molekülorbitale dient die Variationsrechnung. Diese basiert auf der Tatsache, dass wegen der Hermitezität des Hamilton-Operators der Energieerwartungswert jeder beliebigen Funktion höher als der tiefste Energieeigenwert ist. Man muss also in einer Extremwertaufgabe die Funktion mit dem tiefsten Energieerwartungswert auswählen. Diese ist dann wahrscheinlich die beste Näherung. Es reicht aber nicht aus, eine einmalige Variationsrechnung durchzuführen. Über die Hartree-Fock-self-consistent-field-Methode werden Orbitale iterativ bestimmt. Das Prinzip ist, dass für jedes Elektron, das Feld der anderen Elektronen berücksichtigt wird, welches allerdings nicht exakt bekannt ist, sondern im Verlauf der Iteration immer besser wird. Wichtig ist auch die Born-Oppenheimer-Näherung, nach der die Elektronen- und Kernbewegung isoliert betrachtet werden können. Somit können Elektronenverteilung und Schwingung getrennt behandelt werden. VB-VerfahrenDie Valenzstrukturtheorie (VB-Theorie oder VB-Verfahren von engl. valence bond) nach Walter Heitler, Fritz London, John C. Slater und Linus Carl Pauling geht von lokalisierten Bindungen aus. Sie wird durch die üblichen Strukturformeln (u.U. mit Mesomere) repräsentiert. Sie war historisch entscheidend für das Verständnis der chemischen Bindungen. Heutige Rechnungen werden eher mit der MO-Methode durchgeführt. Rechnerisch werden die Elektronen in verschiedener Art auf die Atomorbitale verteilt und die Linearkombination dieser Valenzstrukturen gebildet, die die geringste Energie besitzt und daher gemäß dem Variationsprinzip die beste Näherung ist. Ein entscheidendes Prinzip bei der VB-Theorie ist Promotion der Elektronen und Hybridisierung der Orbitale. MO-VerfahrenDas MO-Verfahren (von engl. molecular orbital) nach Friedrich Hund und Robert Sanderson Mulliken ordnet alle Elektronen des Moleküls einem Satz Molekülorbitale zu. Die Veranschaulichung erfolgt durch Elektronenwolken, die meist über das gesamte Molekül delokalisiert sind. Molekülorbitale können als Linearkombinationen zu einer endlichen Basis angesetzt werden. Dann werden in einem erweiterten Eigenwertproblem die Molekülorbitale bestimmt. Als Basis können wie von Lennard-Jones vorgeschlagen die Atomorbitale der isolierten Atome im Sinne der LCAO-Näherung (Linear Combination of Atomic Orbitals) verwendet werden. Grundsätzlich könnten beliebige Funktionen als Basis herangezogen werden. Gute Lösungen mit wenig Rechenaufwand werden erhalten, wenn physikalisch sinnvolle Funktionen verwendet werden. Dafür eignen sich, wie Lennard-Jones als erster feststellte, die Atomorbitale, die in isolierten Atomen die Elektronen richtig beschreiben. Man spricht dann von LCAO. Zur Verbesserung können auch die Atomorbitale variiert werden oder weitere Funktionen in den Basissatz eingeschlossen werden. Das MO-Verfahren kann bei kleinen symmetrischen Molekülen intuitiv verstanden werden. Aus Symmetriegründen ergeben sich die Molekülorbitale aus Addition bzw. Subtraktion der Atomorbitale. Bei komplizierteren Molekülen setzen sich die Molekülorbitale als Linearkombination von verschiedenen Atomorbitalen zusammen. Genau genommen wechselwirken auch schon in der zweiten Periode die 2s und 2pz-Orbitale, sodass auch schon dort kompliziertere Linearkombinationen erhalten würden. Bei konjugierten π-Systemen stellt die Hückel-Näherung eine Methode zur groben Bestimmung von MOs dar. Ein grundsätzlicher Fehler dieser Methode ist, dass die Elektronen (bis auf Einhaltung des Pauli Prinzips) als statistisch unabhängig voneinander gesehen werden. Viel aufwendigere korrelierte Rechnungen, v.a. CI (configuration interaction), beachten auch die Elektronen-Korrelation. Zeichnen von LCAO-MO-DiagrammenQualitative LCAO-MO-Diagramme können auch ohne Rechnung gezeichnet werden. Zu beachten ist, dass bei der Linearkombination zweier AOs ein bindendes MO mit tieferer Energie als das tieferliegende AO und ein antibindendes MO mit höherliegender Energie als das höherliegende AO gebildet werden. Die Aufspaltung wird in erster Näherung von der Überlappung bestimmt. So kann man z.B. vorhersagen, dass eine σ-Bindung stärker aufspaltet als eine π-Bindung. σ-Bindung
Als σ-Bindung wird eine Bindung bezeichnet, die rotationssymmetrisch zur Bindungsachse ist. Anders ausgedrückt werden Orbitale mit der magnetischen Quantenzahl ml = 0 kombiniert, d. h. s-, px-, dz2-Orbitale und Mischungen (Hybride) aus diesen. Beispiele:
Das Molekülorbital der DoppelbindungEs ist spiegelsymmetrisch bezüglich der Bindungsachse. σ-π-Modell
Eine Doppelbindung besteht aus einer σ-Bindung und aus einer π-Bindung, wobei die Bindungspartner im sp2-hybridisierten Zustand vorliegen: drei Hybridorbitale weisen in die Ecken eines gleichseitigen Dreiecks, senkrecht dazu steht das py-Orbital, das nicht für die Hybridisierung verwendet wurde. Die σ-Bindung entsteht durch Überlappung zweier Hybridorbitale, die π-Bindung entsteht durch Überlappung der zwei py-Orbitale. Da beide py-Orbitale parallel zu einander stehen müssen, entsteht ein neues Molekülorbital mit einer Knotenebene. Das π-Molekülorbital wird durch Kombination von Orbitalen mit |ml| = 1 gebildet. Es enthält eine Knotenebene in der Kernachse.
τ-Modell
Eine selten angewandte Methode zur Beschreibung von Doppelbindungen ist das τ-Modell. s- und p-Orbitale werden zuerst gemischt (beide C-Atome sind sp³-Hybridisiert) und aus den beiden Hybridorbitalen die Doppelbindung zusammengesetzt. Die τ-Bindungen entstehen durch Überlappung von jeweils zwei Hybridorbitalen, es bilden sich zwei spiegelbildliche Molekülorbitale („Bananen-Bindungen“). Es zeigt sich, dass das τ-Modell Bindungswinkel und -längen passend wiedergibt. Die Unterscheidung ist nur in der VB-Theorie sinnvoll. Bei einer LCAO-Methode gehen die beiden Modelle ineinander über, da in beiden Fällen in der Summe die gleiche Elektronendichte erhalten wird. Diese ist das einzig relevante. Delokalisation
Delokalisation tritt dann auf, wenn ein Molekül mehrere Doppelbindungen enthält, die konjugiert sind. Das heißt, dass zwischen ihnen immer genau eine Einfachbindung ist. Dazu müssen alle pz-Orbitale zueinander parallel und in direkter Nachbarschaft stehen. Dann können alle pz-Orbitale zu einem einzigen Molekülorbital kombiniert werden, was quantenmechanisch bewiesen werden kann.
Beispiele in chemischen VerbindungenWasserstoff
Die zur Bindung notwendigen einsamen Elektronen befinden sich jeweils im 1s-Orbital der beiden Atome Ha und Hb, das durch die Eigenfunktionen ψa(1s) und Ψb(1s) beschrieben wird. Die Addition der Wellenfunktionen ψa(1s) + ψb(1s) ergibt ein rotationssymmetrisches bindendes Molekülorbital ( σ(1s) ) mit erhöhter Ladungsdichte zwischen den Kernen der Bindungspartner. Durch die Anziehung der Kerne durch die Ladung hält das Molekül zusammen. Die Subtraktion der Wellenfunktionen ψa(1s) - ψb(1s) ergibt ein antibindendes Molekülorbital ( σ*(1s) ) mit einer Knoteneben zwischen den Kernen der Bindungspartner. Durch die resultierende geringe Elektronendichte zwischen den Kernen kommt es zu einer Abstoßung der Atome. Die Molekülorbitale können (wie die Atomorbitale) mit maximal zwei Elektronen entgegengesetzten Spins besetzt werden. Da jedes Wasserstoffatom jeweils ein Elektron zur Verfügung stellt, wird das bindende Molekülorbital im energieärmsten Grundzustand mit einem Elektronenpaar besetzt, während das antibindende leer bleibt. (Im angeregten Zustand ist das bindende und das antibindende Molekülorbital mit je einem Elektron besetzt.) Ein anderes Beispiel ist Helium. Hier ist jedes 1s-Orbital bereits mit einem Elektronenpaar besetzt. Bei der Kombination dieser Atomorbitale müsste sowohl das bindende als auch das antibindende Molekülorbital mit je einem Elektronenpaar besetzt werden. Ihre Wirkungen würden sich gegenseitig aufheben, es kommt keine Bindung zustande.
Sauerstoff
Das LCAO-MO-Schema kann wie oben beschrieben qualitativ abgeleitet werden. Jedes Sauerstoff-Atom hat im Grundzustand sechs Valenzelektronen auf dem zweiten Hauptenergieniveau. Die zwölf Valenzelektronen eines O2-Sauerstoffmoleküls werden auf die vier bindenden (σs, σx, πy, und πz) und drei der vier antibindenden Molekülorbitale (σs*, πy*, πz*) verteilt. Da zwei antibindende Orbitale mit nur einem Elektron besetzt sind (eine „halbe Bindung“), resultiert eine Doppelbindung. Disauerstoff hat mit Grundzustand, einem Triplettzustand, gemäß der Hund'schen Regel zwei ungepaarte Elektronen parallelen Spins. Durch diese Elekronenverteilung lässt sich der Paramagnetismus und der diradikalische Charakter des Sauerstoffs erklären. Interessanterweise senkt der Diradikalcharakter die Reaktionsfähigkeit, da eine konzertierte Reaktion der Spinerhaltung widersprechen würde. Besonders reaktionsfähig ist der angeregte diamagnetische Singulettsauerstoff. Eine weitere Folge der MO-Besetzung ist, dass es für O2 schwierig ist, eine korrekte Lewis-Formel anzugeben. Entweder wird der Diradikalcharakter vernachlässigt oder die Doppelbindung.
Butadien
Das π-System des Butadiens setzt sich zusammen aus 4 pz-Orbitalen, die am Anfang mit je einem Elektron besetzt sind. Diese 4 Atomorbitale werden nun zu vier Molekülorbitalen linear kombiniert. Die Koeffizienten erhält man durch Symmetrie-angepasste-Linearkombination (SALC) oder nach der Hückel'schen Theorie. Dabei entstehen die rechts gezeichneten Orbitale. Die rot/blaue Färbung gibt an, ob das Orbital vor dem Quadrieren ein negatives oder positives Vorzeichen hatte. Physikalisch hat sie keine Relevanz. Jedes dieser Orbitale kann mit 2 Elektronen besetzt werden. Es werden also die beiden unteren Orbitale voll aufgefüllt und die beiden oberen bleiben leer. Energetische besonders günstig ist das Orbital, bei dem alle pz-Orbitale das gleiche Vorzeichen haben und sich daher die Elektronen fast frei über das ganze Molekül bewegen können. Man erkennt die von SALC geforderte Eigenschaft, dass in jedem Molekülorbital alle Symmetrieelemente des Moleküls erhalten bleiben. Weiterhin sieht man, wie mit zunehmender Energie die Anzahl an Knotenebenen steigt.
BindungsordnungDie Bindungsordnung bezeichnet die Zahl der effektiven Bindungen in einem Molekül. Sie ist die Hälfte der Differenz der bindenden und der antibindenden Valenzelektronen (s. Bindungsordnung). Sie ist einfach abzulesen, da sie gleich der Anzahl der Bindungsstriche in der Lewis- Schreibweise der Verbindung ist. Siehe auchKategorien: Chemische Bindung | Theoretische Chemie |
|||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Molekülorbitaltheorie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||





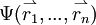 . Das Produkt mit der komplex konjugierten Funktion
. Das Produkt mit der komplex konjugierten Funktion 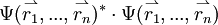 gibt die Wahrscheinlichkeit wieder, das erste Elektron an der Stelle
gibt die Wahrscheinlichkeit wieder, das erste Elektron an der Stelle 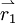 , das 2-te an der Stelle
, das 2-te an der Stelle 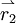 usw. zu finden.
usw. zu finden.
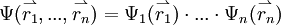 . Die
. Die 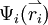 geben die Aufenthaltsbereiche für die einzelnen Elektronen an. Sie werden als Molekülorbitale bezeichnet. Um das
geben die Aufenthaltsbereiche für die einzelnen Elektronen an. Sie werden als Molekülorbitale bezeichnet. Um das 

