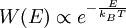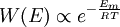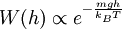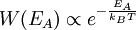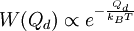Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Boltzmann-FaktorBefinden sich viele Teilchen bei der Temperatur T im thermodynamischen Gleichgewicht, so ist die Wahrscheinlichkeit, W(E) ein Teilchen mit der Energie E anzutreffen, proportional zum Boltzmann-Faktor Produkt-Highlightdabei ist kB die Boltzmann-Konstante. Der Boltzmann-Faktor spielt eine zentrale Rolle in der theoretischen Thermodynamik (statistische Physik), siehe Boltzmann-Statistik. Betrachtet man nicht das Einzelteilchen sondern ein Mol Teilchen ist dabei ist R die allgemeine Gaskonstante. Einfache AnwendungsbeispieleDie potentielle Energie eines Luftmolekül mit Masse m in der Höhe h ist mgh. Die Wahrscheinlichkeit es in dieser Höhe anzutreffen ist proportional zu Zum Start einer chemischen Reaktion ist die molare Aktivierungsenergie EA erforderlich. Die Geschwindigkeit einer chemischen Reaktion ist proportional zu Der Übergang von der Flüssigkeit in die Gasphase erfordert die molare Verdampfungswärme Qd (präziser wäre Enthalpie). Der (Sättigungs-)Dampfdruck ist proportional zu |
| Dieser Artikel basiert auf dem Artikel Boltzmann-Faktor aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |