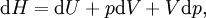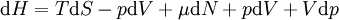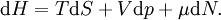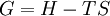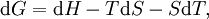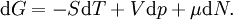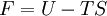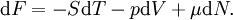Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Charakteristische Funktion (Physik)Die charakteristischen Funktionen bezeichnen in der Thermodynamik die totalen Differentiale und damit die Änderungen der thermodynamischen Potentiale: Innere Energie U, Enthalpie H, Helmholtz-Potential F und Freie Enthalpie G. Produkt-HighlightDie wichtigste charakteristische Funktion ist die aus dem Ersten Hauptsatz der Thermodynamik folgende Fundamentalgleichung Aus den Definition der Enthalpie H folgt wegen und mit der Fundamentalgleichung erhält man und damit die charakteristische Funktion: Aus der Definition der Freien Enthalpie G folgt und damit die charakteristische Funktion Zuletzt noch die Definition des Helmholtz-Potentials F folgt entsprechend
Siehe auch: totales Differential |
| Dieser Artikel basiert auf dem Artikel Charakteristische_Funktion_(Physik) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





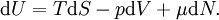
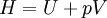
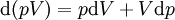 :
: