Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
NitreneNitrene sind einfachbindige Stickstoffverbindungen mit einem Elektronensextet. Somit sind Nitrene Elektronenmangelverbindungen, wodurch sie eine hohe Reaktivität an den Tag legen. Sie reagieren ähnlich und sind auch elektronisch ähnlich aufgebaut wie Carbene. Produkt-Highlight
Struktur und AufbauMan unterscheidet zwischen Singulett- und Triplett- Spinzuständen, je nachdem, ob die beiden freien Elektronen gepaart oder ungepaart sind. Gepaarte Elektronen in einem Orbital führen zu Singulettzuständen, ungepaarte Elektronen zu Triplettzuständen. Im Gegensatz zum Carben sind im Nitren vier an der Bindung nicht beteiligte Elektronen vorhanden. Zwei davon besetzen das bekannte nicht bindende Orbital, wie es in gesättigten Stickstoffverbindungen auch der Fall ist, beispielsweise im Ammoniak oder in Aminen. Die anderen beiden Elektronen befinden sich im Triplettfall in zwei sp-Hybridorbitalen, oder im Singulettfall in einem weiteren sp2Hybridorbital. Im allgemeinen ist der Grundzustand der Triplettzustand, wie man gemäß den Hund'schen Regeln erwarten würde. Die Energiedifferenz zwischen beiden Formen ist jedoch erheblich größer als beim Carben, sodass Singulettzustände schwieriger in Reaktionen zu realisieren sind. Wie im Carben können auch hier starke π-Donorsubstituenten den Singulettzustand stabilisieren. Dies führt im allgemeinen auch zu einer nukleophilen Reaktivität des Nitrens. Durch Einbettung in Tieftemperaturmatrices sind Nitrene heute auch der spektroskopischen Untersuchung zugänglich. SynthesenNitrene sind in der Regel derart reaktiv, daß sie nicht isoliert werden können, sondern in situ erzeugt werden. Aus AzidenDer verbreitetste Weg zur Erzeugung von Nitrenen ist die Thermolyse oder Photolyse von Aziden. In der Regel wird das Azid als Aus IsocyanatenDiese Reaktion ist analog der Carbensynthese aus Ketenen. Unter Abspaltung von Kohlenmonoxid wird das Nitren gebildet. Aromatische Isocyanate können das Nitren durch ihr π-Elektronensystem stabilisieren. durch α-EliminierungIm Gegensatz zum Carben ist dieser Reaktionsweg historisch nicht von Bedeutung. Eine gute Ausgangssubstanz für eine solche Reaktion ist das Arylsulfonylhydroxylamin EtO2C − NH − OSO2Ar. Die Arylsulfonylgruppe ist eine sehr gute Fluchtgruppe und es wird nach Abstraktion des Aminwasserstoffs das Nitren EtO2C − N:: freigesetzt. ReaktionenInsertionenWie bei den Carbenen insertieren Nitrene leicht in C-H-σ-Bindungen. CycloadditionenAn AlkeneMit Alkenen reagieren Nitrene zu dreigliedrigen Heterozyklen, sog. Aziridinen. Die Stereospezifität der Reaktion hängt vom Spinzustand des Nitrens ab. Singulettzustände reagieren unter Retention der Konfiguration. Solange in reinem Alken als Lösemittel gearbeitet wird, erhält man gute Ausbeuten des stereochemisch eindeutigen Produktes. Andere Lösemittel können jedoch das Singulettnitren zum Triplettnitren desaktivieren, wodurch eine eindeutige Stereochemie nicht mehr gewährleistet ist. Wird das Nitren aus einer Azid-Vorstufe hergestellt, so kann es zur Bildung eines fünfgliedrigen Heterozyklus, einem Triazolin kommen, da ein Azid auch als 1,3-Dipol reagieren kann, bevor es zum Nitren zerfällt. An AlkineReaktionen, in denen man aus Aziden synthetisierte Nitrene an Dreifachbindungen addieren möchte, verlaufen meist unter Addition des 1,3-dipolaren Azids zu einem Triazol. Möglich ist dagegen die Reaktion mit primären Aminen (RNH2), welche ein Imidonitren mithilfe eines Oxidationsmittels freisetzen. Das entstehende Azirin ist jedoch antiaromatisch und lagert sich zum Aromaten um, indem der organische Rest des Nitrens an ein Kohlenstoffatom des Azirins wandert. Somit existieren nur noch zwei π-Elektronen und das System ist aromatisch. An AromatenDiese Additionen dienen unter anderem zur Ringerweiterung von cyclischen Aromaten. Es werden zumeist carbonylsubstituierte Nitrene aufgrund ihrer stärkeren Elektrophilie verwendet. Zunächst addiert das Nitren an eine formale Doppelbindung des Aromaten. Es entsteht ein 6-3 Bicyclus. Es kommt zu einer Umlagerung, wobei die beiden Ringen gemeinsame Bindung aufgelöst wird. Zurück bleibt ein, um eine N-Gruppe erweiterter, Cyclus. UmlagerungenWie viele Elektronenmangelverbindungen sind auch Nitrene zu Umlagerungen fähig. Durch 1,2-Verschiebungen von Substituenten des Carbens werden Imine gebildet. Wasserstoffatome wandern aufgrund ihrer geringen Masse am schnellsten. |
|
| Dieser Artikel basiert auf dem Artikel Nitrene aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





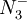 -Ion, beispielsweise aus
-Ion, beispielsweise aus 

