Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
SalzsäuregruppeDie Salzsäure-Gruppe (HCl-Gruppe) ist Bestandteil des Kationentrenngangs, einem klassischen Verfahren der qualitativen Analyse in der Anorganischen Chemie. Die HCl-Gruppe fällt aus der gelösten Probe-/Ur-Substanz aus, wenn diese mit dem Trennmittel konz. Salzsäure versetzt wird. Zur Salzsäure-Gruppe gehören nämlich diejenigen Elemente, die mit dem Trennmittel schwerlösliche Chloride bilden (Fällungsreaktion); Beispiel:
Dies sind neben Silber auch die beiden Elemente Quecksilber und Blei in Form ihrer Kationen Ag+, Hg22+, Pb2+. Diese werden von anderen, weiteren Schwermetallkationen durch Ausfällung und Filtration getrennt – im Filterrückstand befinden sich dann z.B. PbCl2 , Hg2Cl2 , AgCl – im Filtrat die Kationen der folgenden Trenngangs-Gruppen (Schwefelwasserstoff-, Ammoniumsulfid-, Ammoniumcarbonat- und Lösliche Gruppe, siehe unter Kationentrenngang). Der Ausfällung der Salzsäuregruppe folgt eine Trennung der Kationen Hg22+, Pb2+, Ag+ voneinander, um sie anschließend ungestört mit Hilfe von Nachweisreaktionen auffinden zu können. Im folgenden wird der Standardtrennungsgang beschrieben. Produkt-Highlight
Verfahren1.Schritt: Amalgamprobe - Vorprobe auf Silber und QuecksilberionenEin Kupferblechschnipsel wird auf einem Uhrglas unter dem Abzug mit einem kleinen Tropfen der gelösten Analysensubstanz befeuchtet. Nach einigen Minuten sitzt auf dem Kupfer-Blech ein silbriger Belag, der beim Polieren mit einem Filterbausch silberglänzend wird (Amalgambildung nach Redoxreaktion). Wenn der Belag vollständig abgerieben werden kann liegt kein Quecksilber, sondern ausschließlich Silber vor. 2.Schritt: Fällung und Filtration der Salzsäuregruppe
3. Schritt: Abtrennung des Blei-II-chlorides
Der Niederschlag wird unter dem Abzug mehrmals mit 1 ml Wasser und 1 Tropfen ca. 2molarer Salzsäure aufgekocht und heiß durch einen durch kochendes Wasser oder im Trockenschrank und mit Filterpapier auf rund 100 Grad Celsius vorgewärmten Glastrichter filtriert. Das Filtrat lässt man abkühlen, um hieraus Blei durch Zugabe von einem Tropfen ca. 0,5molarer Kaliumchromat- oder Kaliumdichromatlösung als gelbes Blei-II-chromat PbCrO4 nachzuweisen. Alternativ kann Natriumiodidlösung zugegeben, mit der Blei(II)-Ionen als gelbes Blei-II-iodid PbI2 ausfallen. Alternativ kann man auch eine Nadel auskristallisierendes Blei-II-chlorid nehmen und diese auf ein Kaliumiodid-Papier legen. Da sich das schwerlöslichere gelbe Bleiiodid bildet, ist nach einigen Minuten um die Nadel herum ein gelber Hof von Blei-II-iodid zu sehen (siehe auch unter Nachweisreaktionen). 4.Schritt: Trennung des Quecksilber(I)-chlorides (Hg2Cl2) vom SilberchloridEin Teil des Filterrückstandes wird im Reagenzglas mit 1 ml konz. Ammoniaklösung behandelt. Das Auftreten einer Schwarzfärbung (durch Bildung u.a. von Quecksilber) beweist die Gegenwart von Quecksilbersalzen. Der schwarze Niederschlag (Nd.) wird abfiltriert und das Filtrat mit einem Tropfen Salzsäure angesäuert. Es entsteht unter Umständen ein weißer Niederschlag von Silberchlorid, der sich bei Zugabe von verdünntem Ammoniakwasser unter Bildung des Diammin-Silber(I)-ions [Ag(NH3)2]+ löst (siehe unter Nachweisreaktionen). Hinweise zu Umwelt und GesundheitAlle Blei- und Quecksilbersalze sowie Chromate sind giftig und sollten daher nur von Fachleuten in kleinstmöglichen Mengen verwendet werden. Jeglicher Hautkontakt mit der Probe- bzw. Salzlösung ist zu vermeiden (evtl. Handschuhe). Vor jeder Arbeitspause und nach dem Arbeitsende gründlich die Hände waschen! Vor Benutzung dieser Salze informiere man sich der Gefahrstoff-Verordnung (GefStoffVO) entsprechend genauestens über die Risiken (R-Sätze), die einzuhaltenden Sicherheitsratschläge (S-Sätze) und Entsorgungsvorschriften. Chromate und Dichromate (sechswertiges Chrom) sind krebserregend (Kategorie I)! Auch hier gilt: äußerste Sparsamkeit und Genauigkeit im Umgang mit der Chemikalie! Entsorgung: Im gekennzeichneten Becherglas sammeln und mit nascierendem Wasserstoff (aus der Reaktion von Salzsäure mit unedlem Metall, z.B. Zink) oder mit Ethanol in Gegenwart von Schwefelsäure über längere Zeit behandeln. Das hierbei entstehende grüne Chrom(III) entsprechend den anderen Schwermetallen entsorgen. Literatur
Kategorien: Nachweisreaktion | Chemisches Analyseverfahren |
|
| Dieser Artikel basiert auf dem Artikel Salzsäuregruppe aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


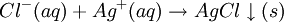 .
.





