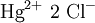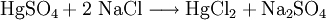Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Quecksilber(II)-chlorid
Quecksilber(II)-chlorid ist ein weißes, in Wasser mäßig lösliches, sehr giftiges Salz, das bei 281 °C schmilzt. Da es beim Erhitzen leicht sublimiert, bezeichnet man es als Sublimat, so dass die Schmelze bei 302 °C kaum beobachtet werden kann.[2] Bemerkenswert ist, dass die Verbindung in wässriger Lösung nur geringfügig in Ionen dissoziiert vorliegt. In verstärktem Maße gilt das für das Quecksilber(II)-cyanid. Quecksilber(II)-chlorid ist im Vergleich zu anderen Halogeniden wie Quecksilber(II)-iodid, welche in Wasser nur im ppm-Bereich löslich sind, recht gut löslich. Produkt-HighlightHerstellungQuecksilber(II)-chlorid entsteht beim Erhitzen von Quecksilber(II)-sulfat mit Natriumchlorid. Bei der Reaktion von Quecksilber(I)-chlorid mit Chlor oder von Quecksilberoxid mit Salzsäure oder auch direkt aus den Elementen Quecksilber und Chlor in beheizten Retorten entsteht Quecksilber(II)-chlorid. VerwendungQuecksilber(II)-chlorid wirkt pilztötend, darum wurde es früher zum Beizen von Saatgut und zur Imprägnierung von Holz verwendet (Kyanisierung). Da es außerdem antiseptisch wirkt, wurde es als Desinfektionsmittel bei Wunden verwendet. In starker Verdünnung wurde es sogar als Arzneistoff eingesetzt.[3] Aufgrund seiner fixierenden Wirkung wurde es bis um 1900 als Konservierungsmittel für anatomische Präparate benutzt. Auf Grund seiner Giftigkeit werden jedoch heute andere Stoffe benutzt. Quecksilber(II)-chlorid ist Bestandteil von Ätzmitteln für die Stahl- und Kupferätzung, Katalysator in der Synthesechemie (z. Bsp. bei der Herstellung von Vinylchlorid) und wird auch als Depolarisator in Trockenbatterien verwendet.[3] Quellen
Kategorien: Giftiger Stoff | Umweltgefährlicher Stoff | Quecksilberverbindung | Chlorid | Ätzender Stoff |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Quecksilber(II)-chlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||||