Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Siliciumtetrafluorid
Siliciumtetrafluorid (SiF4), eine Siliciumverbindung, ist ein farbloses giftiges unbrennbares Gas. Es hat einen stechenden Geruch und ist bei Feuchtigkeit stark rauchend. Es wechselt beim Abkühlen durch Sublimation von der gasförmigen Phase direkt in die feste Phase. Das Gas ist ab einem Druck von 50 at verflüssigbar. Produkt-Highlight
HerstellungVerfahren 1Hergestellt wird es aus Calciumfluorid und Siliciumdioxid (Sand) mit konzentrierter Schwefelsäure. Folgende Reaktionen laufen ab: Umsetzung von Fluorit zur Fluorwasserstoff Der Fluorwasserstoff reagiert dann mit dem SiO2 Unter Säureüberschuß wird die Hydrolysierung des SiF4 verhindert. Das so erhaltene SiF4 ist allerdings nur 80 - 90 prozentig. Es enthält sauerstoffhaltige Produkte wie F3Si-O-SiF3 oder F3Si-O-SiF2-O-SiF3. Beim Transport von SiF4 in Pipelines zerfallen diese Moleküle in SiF4 und SiO2. Dabei setzt das SiO2 die Rohrleitungen zu. Die chemische Industrie hatte das Verfahren des Transportes von SiF4 in Pipelines anstelle der gefährlicheren HF entwickelt, um entferntere Produktionsstätten per Pipeline mit Fluoriden zu versorgen. Aufgrund der geschilderten Probleme fand dieses Verfahren jedoch keine Verbreitung.[3] Verfahren 2Beim Erhitzen von Bariumfluorosilikat entsteht SiF4: AnwendungenIn der Halbleiterindustrie entsteht es beim Entfernen von SiO2 Schichten auf Wafern mittels Flusssäure. Quellen und Literatur
Wiki/Weblinks
Kategorien: Giftiger Stoff | Ätzender Stoff | Siliciumverbindung | Fluorverbindung |
||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Siliciumtetrafluorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||







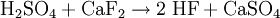
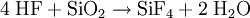
![\mathrm{Ba[SiF_6] \rightarrow BaF_2 + SiF_4}](images/math/f/6/4/f648d1e994b7ad1c095688a43730b551.png)


