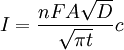Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AmperometrieDie Amperometrie ist eine elektrochemische Methode zur quantitativen Bestimmung von chemischen Stoffen. Weiteres empfehlenswertes Fachwissen
AllgemeinesDie amperometrische Methode ist gekennzeichnet durch die Messung eines Elektrolysestroms an einer Arbeitselektrode, während ein zeitlich konstantes elektrochemisches Potential anliegt. Damit leitet sich die Amperometrie von der Voltammetrie ab, bei welcher die Elektrolysespannung mit der Zeit verändert wird. Der gemessene Elektrolysestrom ist der Konzentration des umgesetzten Stoffes direkt proportional. Dies gestattet eine Bestimmung unbekannter Konzentrationen mit Hilfe einer Kalibrierfunktion. Häufig verwendete Materialien für Arbeitselektroden sind: Platin, Gold, Kohlenstoff, Quecksilber und Silber. Beim Clark-Sensor wird gelöster Sauerstoff bei einem konstanten Potential reduziert. Dieses Prinzip der Sauerstoffbestimmung ist vielfach in Industrie und Umweltanalytik Gebrauch. Die Arbeitselektroden amperometrischer Sensoren können mit einer Schicht überzogen sein, die selektiv mit dem zu analysierenden Stoff reagiert. Sehr weit verbreitet in der medizinischen Diagnostik sind amperometrische Glucosesensoren, die mit dem Enzym Glucose-Oxidase modifiziert sind. In seiner Funktion als Biokatalysator setzt dieses Enzym den Analyten Traubenzucker (Glucose) zu Gluconsäure und Wasserstoffperoxid um. Dabei wird Sauerstoff verbraucht. Amperometrisch registriert wird eigentlich die Zunahme der Wasserstoffperoxidkonzentration oder die Abnahme der Sauerstoffkonzentration, je nach Wahl des Elektrolysepotentials. ChronoamperometrieHierbei handelt es sich um eine Relaxationsmethode mit einem Potentialsprung und Registrierung des sich ändernden Elektrolysestroms. Zunächst wird ein Potential an die Arbeitselektrode angelegt, bei welchem noch kein Umsatz des Analyten erfolgt. Durch sprunghafte Änderung des Potentials auf einen neuen zeitlich konstanten Wert beginnt die Oxidation bzw. Reduktion des Analyten und ein elektrochemischer Strom beginnt zu fließen. Dieser Strom hat unmittelbar nach dem Potentialsprung seinen maximalen Wert und fällt dann ab. Der zeitliche Verlauf wird durch die Cottrellgleichung beschrieben.
Hierin bedeuten:
BiamperometrieBei dieser vereinfachten Variante der Amperometrie wird mit zwei gleichen Arbeitselektroden gearbeitet, die beispielsweise aus je einem Platindraht bestehen. Es kann nur dann ein Elektrolysestrom fließen, wenn an beiden Elektroden Stoffumsetzung erfolgt. Dies tritt dann ein, wenn beide Komponenten elektroaktive Spezies sind und die elektrische Spannung zwischen beiden Elektroden hinreichend groß ist (meist 10-100) mV. Verwendet wird diese Methode bei der Dead-Stop-Titration. LiteraturKarl Cammann (Hrsg.), Instrumentelle Analytische Chemie, Spektrum Akademischer Verlag, Heidelberg - Berlin, 2001. |
|
| Dieser Artikel basiert auf dem Artikel Amperometrie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |