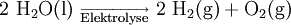Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
ElektrolyseUnter Elektrolyse (griech. „mittels Elektrizität trennen“) versteht man die Aufspaltung einer chemischen Verbindung unter Einwirkung des elektrischen Stroms. Auch die elektrolytische Auflösung von Metallen in oder die Abscheidung aus einem wässrigen Medium zur Reinigung oder Schichterzeugung wird oft als Elektrolyse bezeichnet. Hierunter fallen die katalytische Metallabscheidung, die elektrolytische Raffination z. B. von Kupfer und im Prinzip auch das Laden eines Akkumulators. Die Elektrolyse ist die Umkehrung der Vorgänge in einer Batterie, der Entladung eines Akkumulators oder des Betriebs einer Brennstoffzelle. Bei der Elektrolyse wird somit elektrische in chemische Energie umgewandelt. Besonders im Falle der Wasserzerlegung in Wasserstoff und Sauerstoff ist das auch das Ziel der Elektrolyse. Produkt-Highlight
Prinzip
Durch zwei Elektroden wird ein elektrischer Gleichstrom in eine leitfähige Flüssigkeit geleitet. An den Elektroden entstehen durch die Elektrolyse Reaktionsprodukte aus den im Elektrolyten enthaltenen Stoffen. Die Spannungsquelle bewirkt einen Elektronenmangel in der mit dem Pluspol (Anode) verbundenen Elektrode und einen Elektronenüberschuss in der anderen, mit dem Minuspol (Kathode) verbundenen Elektrode. Die Lösung zwischen der Kathode und Anode enthält als Elektrolyte positiv oder negativ geladene Ionen. Die positiv geladenen Kationen wandern durch das Anlegen einer Spannung zur negativ geladenen Kathode. An der Kathode nehmen sie ein oder mehrere Elektronen auf und werden dadurch reduziert. An der Anode läuft der entgegengesetzte Prozess ab. Dort geben die negativ geladenen Anionen Elektronen ab, werden also oxidiert. Die Menge der an der Anode übertragenen Elektronen ist gleich der an der Kathode übertragenen. Die Spannung, die zur Elektrolyse mindestens angelegt werden muss, wird als Zersetzungsspannung (Uz oder Ez) bezeichnet. Diese oder eine höhere Spannung muss angelegt werden, damit die Elektrolyse überhaupt abläuft. Für jeden Stoff, für jede Umwandlung von Ionen zu zwei oder mehratomigen Molekülen kann die Zersetzungsspannung, das Abscheidepotential anhand des Redoxpotentials ermittelt werden. Aus dem Redoxpotential erhält man noch weitere Hinweise, wie zur elektrolytischen Zersetzung von Metallelektroden in Säure oder zur Verminderung von Zersetzungsspannung durch Abänderung des pH-Wertes. So lässt sich durch das Redoxpotential berechnen, dass die anodische Sauerstoffbildung bei der Wasserelektrolyse von Wasser in basischer Lösung (Zersetzungsspannung: 0,401 V) unter geringerer Spannung abläuft als in saurer (Zersetzungsspannung: 1,23 V) oder neutraler (Zersetzungsspannung: 0,815 V) Lösung, an der Kathode hingegen bildet sich Wasserstoff leichter unter sauren Bedingungen als unter neutralen oder basischen Bedingungen. Sind in einer Elektrolytlösung mehrere reduzierbare Kationen vorhanden, so werden zunächst die Kationen reduziert, die in der Redoxreihe (Spannungsreihe) ein positiveres (schwächer negatives) Potential haben. Bei der Elektrolyse einer wässrigen Kochsalzlösung bildet sich an der Kathode normalerweise Wasserstoff und nicht Natrium. Auch beim Vorliegen von mehreren Anionenarten, die oxidiert werden können, kommen zunächst diejenigen zum Zuge, die in der Redoxreihe möglichst nahe am Spannungsnullpunkt liegen, also ein schwächeres positives Redoxpotential besitzen. Normalerweise entsteht bei der Elektrolyse von wässriger NaCl an der Anode daher Sauerstoff und nicht Chlor. Nach Überschreiten der Zersetzungsspannung wächst mit Spannungszunahme proportional auch die Stromstärke. Nach Faraday ist die Gewichtsmenge eines elektrolytisch gebildeten Stoffs proportional zu der geflossenen Strommenge (Stromstärke multipliziert mit der Zeit, s. Faradaysche Gesetze). Für die Bildung von 1 g Wasserstoff (ca. 11,2 Liter, bei der Bildung eines Wasserstoffmoleküls werden zwei Elektronen benötigt) aus wässriger Lösung wird eine Strommenge von 96485 C (1 C = 1 A · s) benötigt. Bei einer Stromstärke von 1 A dauert die Bildung von 11,2 Litern Wasserstoff also 26 Stunden und 48 Minuten.
Kurz nach Abschaltung einer Elektrolyse kann man mit einem Amperemeter einen Stromausschlag in die andere Richtung feststellen. In dieser kurzen Phase setzt der umgekehrte Prozess der Elektrolyse, die Bildung einer galvanischen Zelle ein. Hierbei wird nicht Strom für die Umsetzung verbraucht, sondern es wird kurzzeitig Strom erzeugt; dieses Prinzip wird bei Brennstoffzellen genutzt. Mitunter ist es ratsam Kathodenraum und Anodenraum voneinander zu trennen und nur durch ein poröses Diaphragma - häufig einem Ionenaustauscherharz - oder einer Salzbrücke um den Ladungsaustausch zwischen Anoden- und Kathodenraum aufrecht zu erhalten. Bei der technischen Elektrolyse zur Herstellung von Natronlauge ist dies recht wichtig. Wenn man durch eine Elektrolyse eine Trennung einzelner Moleküle oder Bindungen erzwingt, wirkt gleichzeitig ein galvanisches Element, dessen Spannung der Elektrolyse entgegenwirkt. Diese Spannung wird auch als Polarisationsspannung bezeichnet. ElektrodenEs gibt nur wenige Anodenmaterialien, die während der Elektrolyse inert bleiben, also nicht in Lösung gehen, z. B. Platin und Kohlenstoff. Einige Metalle lösen sich trotz stark negativem Redoxpotential nicht auf, diese Eigenschaft wird als „Passivität“ bezeichnet. In saurer Lösung müssten sich nach der Nernstschen Gleichung die Mehrzahl der Metalle unter Kationen- und Wasserstoffbildung auflösen. Bis auf Kupfer, Silber, Gold, Platin, Palladium besitzen fast alle Metall/Metallkationenpaare ein negatives Redoxpotential und wären für Elektrolysen in saurem Milieu ungeeignet, da sich das Gleichgewicht (Metallatom und Wasserstoffprotonen) zur Kationenbildung und Wasserstoff verschiebt. Eisen, Nickel, Titan können wegen der Passivität auch in saurem Milieu verwendet werden, jedoch werden auch diese Anodenmaterialien vorzugsweise im basisches Milieu verwendet. Eine Eisenanode, die mit konzentrierter Salpetersäure behandelt wurde, löst sich nicht auf, durch die Passivierung gehen keine Eisen(II)- oder Eisen(III)-ionen in Lösung. Es hat sich eine sehr dünne und stabile Eisenoxidschicht (ähnlich wie beim Aluminium) gebildet, die die weitere Auflösung der Elektrode verhindert. Eisenanoden weisen im Vergleich zu anderen Anodenmaterialien nur eine sehr geringe Überspannung bei der Sauerstoffentwicklung auf, daher werden sie vorzugsweise bei der Erzeugung von Sauerstoff eingesetzt. Hemmungserscheinungen an der Anode, die bei der Sauerstoffbildung zu einer Überspannung führen, beobachtet man bei Kohle und Platinanoden. Die Überspannung kann genutzt werden, um bei der Elektrolyse von wässriger Kochsalzlösung Chlor statt Sauerstoff zu erzeugen. An Zink-, Blei- und besonders Quecksilberkathoden zeigen Wasserstoffprotonen eine erhebliche Überspannung und die Bildung von Wasserstoff erfolgt erst bei einer viel höheren Spannung. Die erhebliche Überspannung von Wasserstoff an der Quecksilberkathode, an der Natrium als Amalgam gebunden wird und so dem Gleichgewicht entzogen wird, nutzt man zur technischen Herstellung von Natronlauge. Durch die erhebliche Überspannung an dieser Elektrode bei der Wasserstoffbildung ändert sich die Redoxreihe, statt Wasserstoffprotonen wandern nun Natriumkationen zur Quecksilberkathode. ÜberspannungSowohl an der Kathode als auch an der Anode können Überspannungen auftreten und somit die benötigte Spannung gegenüber den Berechnungen nach der Nernst-Gleichung erhöhen. Die Überspannungen sind bei Gasbildungen (z.B. Wasserstoff- und Sauerstoffbildung) mitunter beträchtlich. Die aufgebrachte Überspannungsenergie geht als Wärme verloren, trägt also nicht zum Stoffumsatz bei. Je nach Metallart variieren die Überspannungen. Stromstärke und Temperatur beeinflussen ebenfalls die Überspannung. Eine wachsende Stromstärke erhöht leicht die Überspannung, eine Temperaturerhöhung senkt dagegen die Überspannung. Die nachfolgende Tabelle gibt einen kurzen Überblick bezüglich der Überspannung bei der anodischen Sauerstoffentwicklung:
Bei der kathodischen Wasserstoffentwicklung weisen Platin (η = 0,4 V, 0,1 A/cm²), Gold (η = 0,32 V, 0,1 A/cm²) und Nickel (η = 0,51 V, 0,1 A/cm²) geringe Überspannungen auf. ZellwiderstandDer elektrische Widerstand einer Elektrolysezelle behindert den Stromfluss (Ohmsches Gesetz) und sollte daher minimiert werden, andernfalls geht Energie in Form von Wärme verloren. Der Widerstand einer Elektrolysezelle hängt vom Elektrodenabstand, von der Größe der Elektrodenfläche und von der Leitfähigkeit ab. Allgemein gilt für die Berechnung des Widerstands einer Elektrolysezelle: R(z)= (Elektrodenabstand/Elektrodenfläche)*(1/Leitfähigkeit) In destillierten Wasser ist die Leitfähigkeit sehr gering - der Widerstand also sehr hoch - und eine Elektrolyse schlecht möglich. Leitfähigkeit einiger Lösungen
Die Leitfähigkeiten von Lösungen geringer Konzentrationen lassen sich über die spezifische Leitfähigkeit bzw. die Äquivalentleitfähigkeiten der Ionen berechnen. Die Leitfähigkeit von Lösungen sehr hoher Konzentration muss experimentell bestimmt werden. Obwohl bei starken Säuren die Leitfähigkeit höher als in basischen Lösungen gleicher Konzentration ist, werden viele Elektrolysen -aufgrund der anodischen Auflösungsvorgänge bzw. der verzögerten Sauerstoffbildung bzw. Halogenoxidation im sauren Bereich - vorwiegend in basischen Medium ausgeführt. Elektrolyse von WasserDie Elektrolyse von Wasser besteht aus zwei Teilreaktionen, die an den beiden Elektroden (Kathoden- und Anodenräumen) ablaufen. Das Gesamt-Reaktionsschema dieser Redoxreaktion lautet:
Die Elektroden tauchen in Wasser ein, welches durch die Zugabe von etwas Schwefelsäure besser leitend gemacht wird. Dies kann man z. B. auch mit Kochsalz machen, wobei dann anstatt Sauerstoff Chlor gewonnen wird. Großtechnisch wird bei der Wasserelektrolyse eine hochkonzentrierte wässrige KOH-Lösung verwendet. Positiv geladene Oxonium-Ionen (H3O+) wandern im elektrischen Feld zu der negativ geladenen Elektrode (Kathode), wo sie jeweils ein Elektron aufnehmen. Dabei entstehen Wasserstoff-Atome, die sich mit einem weiteren, durch Reduktion entstandenen H-Atom zu einem Wasserstoff-Molekül vereinigen. Übrig bleiben Wasser-Moleküle. Kathodenraum: 2 H3O+ + 2 e- → H2 + 2 H2O oder auch: 2 H2O + 2 e- → H2 + 2 OH- Der abgeschiedene, gasförmige Wasserstoff steigt an der Kathode auf, wobei der Kathodenraum basischer wird. Die negativ geladenen Hydroxid-Anionen wandern zur positiven Anode - soweit dies nicht durch Teilung von Anoden- und Kathodenraum, dem Einsatz von Leitsalzen und von Ionenaustauschern verhindert wird - wobei sich negative Hydroxidionen mit Protonen zu Wasser neutralisieren oder sich an der Anode unter Elektronenabgabe zu Sauerstoff umwandeln.
Auch hier steigt der abgeschiedene Sauerstoff als farbloses Gas an der Anode auf, gleichzeitig wird der Anodenraum saurer. Die entstandenen Protonen wandern in Richtung Kathode - analog zu den Vorgängen im Kathodenraum. Die Gesamtreaktionsgleichung der Elektrolyse von Wasser lautet: 4 H3O+ + 4 OH- → 2 H2 + O2 + 6 H2O Die auf der linken Seite stehenden Hydronium- (neuer: „Oxonium-Ionen“) und Hydroxid-Ionen entstammen der Autoprotolyse des Wassers: 8 H2O → 4 H3O+ + 4 OH- Man kann die Elektrolysegleichung daher auch folgendermaßen schreiben: 8 H2O → 2 H2 + O2 + 6 H2O bzw. nach Kürzen des Wassers: 2 H2O → 2 H2 + O2 Zur Geschichte1800 erfand Alessandro Volta die erste brauchbare Batterie, die voltasche Säule. Mit dieser Stromquelle waren erstmals auch gezielte Anwendungen der Elektrolyse möglich, und bald darauf wurde sie genutzt – vor allem von Humphry Davy in den Jahren 1807 und 1808, um die bis dahin unbekannten Elemente Natrium, Kalium, Barium, Strontium, Kalzium und Magnesium herzustellen. Michael Faraday untersuchte die Elektrolyse genauer und entdeckte ihre Grundgesetze, nämlich die Abhängigkeit der umgesetzten Massen von Ladung und Molmasse. Außerdem schuf Faraday auch die Begriffe Elektrolyse, Elektrode, Elektrolyt, Anode, Kathode, Anion und Kation, veröffentlicht in seiner Arbeit 1832/1834. 1886 entwickelten Paul Louis Toussaint Héroult und Charles Martin Hall eine Elektrolysemethode zur Gewinnung von Aluminium, die heute nach den Entdeckern Hall-Héroult-Prozess genannt wird und die Grundlage heutiger Verfahren ist. Schon zwei Jahre später wurden Firmen gegründet, die diese anwandten, und 1900 wurden bereits 80.000 Tonnen Aluminium elektrolytisch gewonnen. Versuchsaufbau zur Elektrolyse im wässrigen Medium
AnwendungenStoffgewinnungDie Metalle Aluminium und Magnesium werden elektrolytisch mithilfe der Schmelzflusselektrolyse hergestellt. Elektrochemisch werden ferner Kupfer, Silber und Gold gewonnen, ferner zu großen Teilen auch Zink und Nickel. Weitere Alkalimetalle und die meisten Erdalkalimetalle werden ebenfalls durch Schmelzflusselektrolyse gewonnen. Sowohl dabei als auch bei Elektrolyse in wässrigen Medien werden je nach Ausgangsstoff die Halogene Fluor, Brom und Chlor frei, die in großem Maßstab für weitere Synthesen verwendet werden. In der Chloralkali-Elektrolyse wird aus Steinsalz Chlor, Wasserstoff und Natronlauge hergestellt. Mit der Biorock-Technologie ist es möglich, im Meer zu bauen. Hier werden Aragonit und Brucit an ein Stahlgerüst angelagert. GalvanikElektrolytische Metallabscheidungen gehören zu den wichtigsten Anwendungen, entweder zur Erzeugung von metallischen Überzügen bei der Galvanik (galvanisches Verzinken, Verchromen usw.) oder zur Herstellung und Verstärkung von Leiterbahnen in der Leiterplattenproduktion. Elektrolytische RaffinationDie Reinigung und Trennung von Metallen wird bei der Elektroraffination dadurch erreicht, dass sich durch elektrischen Strom eine (unreine) Anode löst und an der Kathode selektiv nur das Metall abgeschieden wird, welches gereinigt werden soll. Dieser Prozess wird insbesondere bei der Herstellung von Elektrokupfer angewendet, da Kupfer aufgrund seiner großen Fähigkeit, im flüssigen Zustand andere Stoffe zu lösen, nur schwer anders zu reinigen ist. Elektrokupfer hat eine Reinheit von >99,5 % und wird hauptsächlich für elektrische Leiter verwendet. Hierfür ist die Reinheit besonders wichtig, da im Kupfer gelöste Verunreinigungen (Sauerstoff, andere Metalle) die spezifische elektrische Leitfähigkeit stark senken. Die Elektroraffination von Kupfer liefert in den Rückständen (Schlamm) am Boden des Elektrolysiergefäßes weitere wertvolle Stoffe, insbesondere die Edelmetalle Gold und Silber, aber auch Selen und Antimon, die in weiteren Trennungsschritten gewonnen werden. Gold und Silber werden bei der Kupferraffination nicht an der Kathode abgeschieden, obgleich diese Elemente nach dem Normalpotential positiver als Kupfer sind. WasserzerlegungDie Elemente Wasserstoff und Sauerstoff sind prinzipiell durch Wasserelektrolyse im Elektrolyseur gewinnbar. Bisher ist es jedoch noch billiger, den chemischen Grundstoff Wasserstoff aus Erdöl oder Erdgas und Sauerstoff aus der Luft zu gewinnen. Die elektrolytische Gewinnung kann jedoch in Gegenden rentabel sein, in denen billiger Strom, z. B. aus Wasserkraft, zur Verfügung steht. Wenn Erdgas und Erdöl knapper werden, ist zu erwarten, dass zukünftig die Wasserelektrolyse zur Gewinnung von Wasserstoff als chemischen Grundstoff und auch als Energieträger mittels elektrischer Energie (z. B. aus Solarstrom oder aus Kernfusionskraftwerken) an Bedeutung zunimmt. Der energetische Wirkungsgrad der Elektrolyse von Wasser liegt bei ca. 70%; bei der alkalischen Elektrolyse sind es bis etwa 90%. Mehrere Anlagenhersteller (z.B. Electrolyser Corp., Brown Boweri, Lurgi, De Nora) bieten große Elektrolysegeräte mit einem noch höheren Wirkungsgrad - von nahezu 100% - an. Da die Elektrolytkonzentration und die Temperatur einer Elektrolytlösung großen Einfluß auf den Zellwiderstand und somit auf die Energiekosten haben, wird bei modernen Anlagen eine 25-30%ige KOH Lösung verwandt, die Temperatur liegt bei ca. 70-90°C. Die Stromdichte liegt bei ca. 0,15 A/cm2, die Spannung bei ca. 1,90 V. Zur Herstellung von 1 m3 Wasserstoff wird bei modernen Anlagen eine Stromenergie von 4,3 –4,9 kWh benötigt. Bei Verwendung von Iridiumdioxid-Katalysatoren als Anode, Platin als Kathode und perfluorierten sulfonsäurehaltigen Membranen (Nafion) als Elektrolyt wurden kürzlich Wirkungsgrade von 93% erreicht. Diese Wirkungsgrade sind insbesondere bei der Nutzung von Wasserstoff als Energiespeicher wichtig, wenn beispielsweise aus saisonal, regional oder tageszeitbedingt schwankenden regenerativen Energiequellen eine stabile Stromversorgung mittels Brennstoffzellen etabliert werden soll. Kolbe-ElektrolyseDie Kolbe-Elektrolyse ist das älteste Beispiel einer organischen elektrochemischen Reaktion. Bei dieser Elektrolyse werden zwei Carbonsäuremoleküle unter CO2-Abspaltung gekuppelt. Weitere ArtenWenig dokumentiert ist die elektrodynamische Elektrolyse, in der die Ionen in einem pulsierenden elektrischen und magnetischen Feld beschleunigt werden. Zur Optimierung des Wirkungsgrades der Elektrolyse können auch Temperaturerhöhung und Photonenbestrahlung (Solarhydrolyse) Einsatz finden. Auch Vakuum kann in der Extraktion von gasförmigen Elektrolyseprodukten wirkungsgraderhöhend angewandt werden. Spezialfälle der Elektrolyse sind die Voltammetrie und die Polarographie. Hier verwendet man die Messung des Elektrolysestromes in Abhängigkeit von der Spannung, um Aufschluss über die chemische Zusammensetzung des Elektrolyten zu erhalten. Quantitative Analyse: Die Zersetzung von Elektrolyten durch elektrischen Strom wird in der Elektrogravimetrie und in der Coulometrie angewendet, um Informationen über den Metallgehalt einer Probe zu erlangen. WirtschaftlichesNach Angaben des Statistischen Bundesamtes wurden im Jahr 2005 die folgenden Mengen an Metallen oder Chemikalien in Deutschland hergestellt.
AusblickDie Elektrolyse, mit ihren sehr hohen Wirkungsgraden bei Stoffumwandlungen, könnte neben erneuerbaren Energien zu einem synergetischen Schlüsselverfahren für die Menschheit werden, um sich langfristig ausreichend Energie zu verschaffen. Im Gegensatz zur Verbrennung der fossilen, endlichen Rohstoffreserven (Erdöl und Erdgas) ließe sie sich noch Jahrhunderte oder gar Jahrtausende fortführen und könnte so den durch Kohlendioxid verursachten Treibhauseffekt entschärfen. Beispiele hierzu könnten sein:
Für eine Kernfusion wird das Deuteriumoxid, das aus der Elektrolyse von Wasser erhalten werden kann, benötigt. In einer Deuteriumoxid-Lösung könnten eventuell - so ließen erste, später als Fälschung entlarvte Meldungen über eine „kalte Fusion“ vermuten - Kernfusionsreaktionen an den Elektroden einer Elektrolyseapparatur stattfinden [1]. Dabei entsteht Energie. Das Hauptprodukt, das bei der elektrolytischen Gewinnung von Deuteriumoxid anfällt, ist jedoch Wasserstoffgas. Dieses kann in Brennstoffzellen oder auch als verflüssigtes Gas zur Energiegewinnung genutzt werden. Die Elektrolyse von 20 Litern Wasser ergibt 12 ml Deuteriumoxid und 25 m³ Wasserstoffgas.
Wasserstoff ist Energieträger für viele Reaktionen, er lässt sich mit Kohlendioxid (beispielsweise aus Verbrennungsgasen), Kohlenmonoxid (als Synthesegas-Gemisch) oder Kohle katalytisch zu Methanol umwandeln, z.B. unter Druck und erhöhter Temperatur. Möglich ist aber auch die Elektrolyse von Karbonatlösungen.[1] [2] Methanol kann in Verbrennungsmotoren oder in Brennstoffzellen eingesetzt werden.
Es wurde vorgeschlagen, durch elektrolytische Herstellung von Natronlauge aus Kochsalzlösungen und der Nutzung der Natronlauge zur Minimierung des Kohlendioxidanteils in Verbrennungsgasen, den durch Kohlendioxid verursachten Treibhauseffekt einzudämmen. Die Natronlauge (oder auch Kalilauge) bildet bei Kohlendioxideinleitung Soda oder Natriumbicarbonat.[3] Das im Salz gebundene Kohlendioxid könnte als dauerhafter oder temporärer (beispielsweise in elektrolytischen oder thermischen Prozessen) Kohlendioxidspeicher für die Methanolproduktion dienen. Das Problem bei dieser Art Kohlendioxid-Bindung ist jedoch, dass zur Elektrolyse von Kochsalzlösung elektrische Energie benötigt wird, die u. U. aus Kohlekraftwerken stammt. Aus diesem Grunde würden der Kohlendioxid-Ausstoß und somit der Treibhauseffekt bei Verwirklichung dieses Vorschlages eher erhöht. Die chemische Assimilation von Kohlendioxid aus der Atmosphäre sollte somit besser der Photosynthese, dem Vorbild aus der Natur, überlassen und durch Schonung und Förderung der Wälder gefördert werden. Einzelnachweise
Literatur
Kategorien: Elektrochemie | Trennverfahren |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Elektrolyse aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |