Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Debye-GleichungDie Debye-Gleichung verknüpft die makroskopisch messbare Größe Dielektrizitätskonstante Weiteres empfehlenswertes Fachwissen
Pm ist die molare Polarisation (ihre Einheit ist die eines molaren Volumens, also z. B. m3/mol), M ist die molare Masse (kg/mol) und ρ ist die Dichte (kg/m3). Die Debye-Gleichung vereinigt die temperaturunabhängige Verschiebungspolarisation und die temperaturabhängige Orientierungspolarisation. Für unpolare Stoffe ohne permanentes Dipolmoment (μ = 0, d. h. nur induzierte Dipole) geht die Gleichung in die Clausius-Mossotti-Gleichung über. Siehe auch |
| Dieser Artikel basiert auf dem Artikel Debye-Gleichung aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


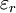 mit den mikroskopischen (molekularen) Größen elektrische Polarisierbarkeit
mit den mikroskopischen (molekularen) Größen elektrische Polarisierbarkeit