Steife Fasern aus Schleim gesponnen
Nanopartikel aus Sekret von Stummelfüßern bilden Polymerfäden, die in Wasser recycelt werden können
Die Natur ist immer wieder ein guter Lehrmeister – auch für Materialwissenschaftler. An Stummelfüßern haben Wissenschaftler nun einen bemerkenswerten Mechanismus beobachtet, durch den sich Polymermaterialien bilden. Um Beute zu fangen, schießen die wurmartigen Kleintiere mit einem klebrigen Sekret, das sich unter Krafteinwirkung zu festen Fäden versteift. Das Besondere: Die Fäden lassen sich wieder auflösen und danach erneut bilden. Dass sich aus dem zuvor flüssigen Sekret reversibel Polymerfasern ziehen lassen, ist für die Forscher ein sehr interessantes Konzept. Gut möglich, dass sie eines Tages in der Lage sein werden, neuartige recycelbare Materialien nach dem Prinzip der Stummelfüßer nachhaltig zu synthetisieren.
Manche Tiere produzieren erstaunliche Materialien. Spinnenseide etwa übertrifft in Sachen Festigkeit sogar Stahl. Muscheln sondern Byssusfäden ab, mit denen sie sich unter Wasser fest an Steine heften können. Ähnlich beeindruckend ist das, was sogenannte Stummelfüßer von sich geben. Die kleinen Tiere, die wie eine Mischung aus Regenwurm und Raupe aussehen, verspritzen eine klebrige Flüssigkeit, um Feinde abzuwehren oder Beute zu fangen. Besonders tückisch für Opfer wie Asseln, Grillen oder Spinnen: Sobald diese versuchen, sich aus den Schleimfäden herauszuwinden, verfestigen sich die Fäden durch die Bewegung, so dass es erst recht kein Entkommen mehr gibt.
„Die bei der Bewegung auf den Schleim wirkenden Scherkräfte sorgen dafür, dass dieser zu steifen Fäden aushärtet“, erklärt Alexander Bär, Promotionsstudent beim Stummelfüßer-Experten Georg Mayer an der Universität Kassel, das Phänomen. Um den Schleim einer australischen Stummelfüßer-Art genauer zu untersuchen, arbeitete der Biologe eng mit Forschern des Max-Planck-Instituts für Kolloid- und Grenzflächenforschung in Potsdam zusammen. Der Chemiker Stephan Schmidt etwa, mittlerweile Juniorprofessor an der Heinrich-Heine Universität in Düsseldorf, half bei der Aufklärung der Schleim-Nanostruktur. Weitere Fragen zur chemischen Zusammensetzung und zu molekularen Prozessen bearbeitete eine vom Biochemiker Matt Harrington geleitete Forschungsgruppe im Bereich Biomaterialien des Potsdamer Instituts. Die interdisziplinäre Wissenschaftlergruppe interessierte sich dabei vor allem dafür, wie sich Zusammensetzung und Struktur des Sekrets während der Fadenbildung verändern.
Schleimiger Mix aus Proteinen und Fettsäuren
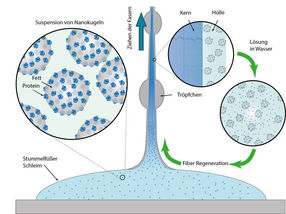
„Wir wussten schon vorher, dass der Schleim vor allem aus großen Proteinmolekülen und Fettsäuren besteht“, sagt Alexander Bär. Am Potsdamer Max-Planck-Institut fanden die Forscher nun heraus, dass Eiweiße und Fette gemeinsam winzige Kügelchen formen. „Die Stummelfüßer produzieren die Protein- und Fettmoleküle sowie weitere Komponenten separat.“, so Bär weiter. „Außerhalb der Drüsenzellen formen sich die Nanoglobuli dann eigenständig und sorgen für die fadenbildenden und klebrigen Eigenschaften.“ Die Kügelchen werden mit bemerkenswerter Präzision gebildet, denn sie sind einheitlich und im Durchmesser immer rund 75 Nanometer groß.
Ihre flüssige Waffe speichern die Stummelfüßer, bis sie zum Einsatz kommt. Durch Muskelkontraktion schießen sie den Schleim dann durch zwei Düsen an beiden Seiten des Kopfes auf Beute oder Feind. „Zunächst ändert sich dabei die klebrige Konsistenz nicht“, sagt Bär. „Aber wenn sich das Beutetier bewegt und dadurch Scherkräfte auf den Schleim wirken, werden die Nanoglobuli zerrissen.“
Schwingungsspektroskopische Untersuchungen in Potsdam zeigten, dass Proteine und Fettsäuren dabei voneinander getrennt werden. „Während Proteine sich im Inneren des Schleimfadens zu langen Fasern formieren, werden die Fett- und Wassermoleküle nach außen verdrängt und bilden dort eine Art Ummantelung“, so Bär. Die Forscher stellten auch fest, dass der Proteinstrang im Inneren eine Steifigkeit aufweist, die der von Nylon® ähnelt. Das erklärt die besonderen Eigenschaften der Fäden.
Ausgehärtete Fäden lösen sich in Wasser wieder auf
Durch weitere Versuche fanden die Wissenschaftler heraus, dass sich die ausgehärteten Schleimfäden nach dem Trocknen binnen einiger Stunden wieder in Wasser auflösen lassen. „Erstaunlich für uns war, dass sich Proteine und Lipide dabei offenbar wieder mischen und es zur Bildung der gleichen Nanoglobuli kommt, die wir schon im Ursprungsschleim gefunden haben“, sagt Matt Harrington. Die neu gebildeten Eiweiß-Fett-Kügelchen wiesen sogar ähnliche Größen wie im natürlichen Sekret auf. „Offenbar gibt es also einen definierten Mechanismus der Selbstorganisation, den wir allerdings noch nicht vollends verstehen“, so Harrington.
Für die Forscher auch interessant: Aus dem zurückgewonnenen Schleim ließen sich erneut klebrige Fäden ziehen. Unter dem Einfluss von Scherkräften verhielten sich diese wie das frisch ausgestoßene Stummelfüßer-Sekret: Sie erhärteten. „Das ist ein schönes Beispiel für einen vollständig reversiblen und beliebig wiederholbaren Regenerationsprozess“, sagt Matt Harrington. Der besondere Charme: Das Ganze erfolgt mit Biomolekülen und bei normaler Umgebungstemperatur. Für die Hersteller künstlicher Polymere also ein Modell, von dem sie sich vielleicht viel für eine nachhaltige Produktion von künstlichen Materialen abschauen können.
Das sieht auch Harrington so. Der Biochemiker kann sich gut vorstellen, dass man eines Tages versuchen wird, in ähnlicher Weise auf Basis nachwachsender Rohstoffe Makromoleküle für industrielle Anwendungen zu synthetisieren. Bei Spinnenseide sei es immerhin schon gelungen, entsprechende Proteine industriell zu produzieren und die daraus erzeugten Fasern an die Bekleidungsbranche zu liefern.
Wie werden Proteine und Fettmoleküle getrennt?
Ein Polymer, das sich – wie der ausgehärtete Faden des Stummelfüßers – in Wasser wieder auflöst, wäre zwar vermutlich wenig praktikabel. Doch entscheidend für weitere Inspirationen bei der Materialentwicklung sei das Prinzip, so Matt Harrington. „Im Moment geht es zunächst noch darum, die Mechanismen besser zu verstehen“, betont der Spezialist für Biomaterialien, der inzwischen eine Professur an der McGill University in Montreal angetreten hat. So interessieren sich die Wissenschaftler etwa dafür, warum mechanische Scherkräfte überhaupt die Trennung der Proteine von den Fettmolekülen bewirken. Oder auch dafür, welche Faktoren die reversible Bildung der immer gleich großen Nanokügelchen steuern. Auch die Frage, wie sich die Proteineinheiten zu starren Fasern anlagern, ohne miteinander feste chemische Bindungen einzugehen, sei noch offen, so Max-Planck-Forscher Harrington.

Schleimige Jagdwaffe: Stummelfüßer, die wie Würmer mit kurzen Beinchen aussehen, fangen ihre Beutetiere mit einem Sekret, aus dem sich Polymerfasern bilden, wenn sich die Opfer bewegen.
© Alexander Bär / Nature Communications 2017
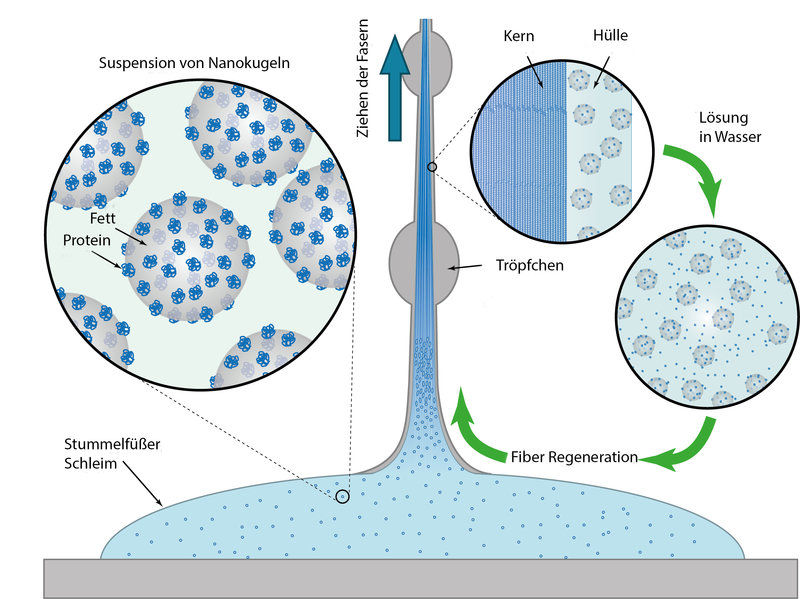
Recycelbare Polymerfasern: Der Schleim von Stummelfüßern enthält Nanokugeln aus Fetten und Proteinen. Scherkräfte bewirken, dass die Proteine Fasern bilden, die von einer fettreichen Schicht eingehüllt werden. Diese lösen sich in Wasser wieder zu den ursprünglichen Nanopartikeln auf, aus denen sich das Polymer erneut formen kann.
© Matthew Harrington / Nature Communications 2017

Originalveröffentlichung
Alexander Baer, Stephan Schmidt, Sebastian Haensch, Michaela Eder, Georg Mayer und Matthew J. Harrington; "Mechanoresponsive lipid-protein nanoglobules facilitate reversible fibre formation in velvet worm slime"; Nature Communications; 17. Oktober 2017
Weitere News aus dem Ressort Wissenschaft
Meistgelesene News
Weitere News von unseren anderen Portalen
Verwandte Inhalte finden Sie in den Themenwelten
Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!

Themenwelt Spektroskopie
Durch die Untersuchung mit Spektroskopie ermöglicht uns einzigartige Einblicke in die Zusammensetzung und Struktur von Materialien. Von der UV-Vis-Spektroskopie über die Infrarot- und Raman-Spektroskopie bis hin zur Fluoreszenz- und Atomabsorptionsspektroskopie - die Spektroskopie bietet uns ein breites Spektrum an analytischen Techniken, um Substanzen präzise zu charakterisieren. Tauchen Sie ein in die faszinierende Welt der Spektroskopie!