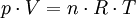Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Avogadrosches Gesetz
Das Avogadrosche Gesetz, auch Gesetz von Avogadro, Avogadrosches Prinzip oder Satz von Avogadro, bezeichnet ein historisches, von Amadeo Avogadro 1811 aufgestelltes Gesetz, nach welchem in gleichen Volumen bei gleicher Temperatur alle Gase eine gleiche Anzahl von Molekülen enthalten, deren Entfernung voneinander im Verhältnis zu ihrer Masse so groß anzunehmen ist, dass sie keine wechselseitige Anziehung aufeinander mehr ausüben. Avogadro leitete dieses Gesetz aus den von Gay-Lussac gefundenen gesetzmäßigen Beziehungen über die Verbindungen gasförmiger Körper ab. Er unterschied Atome und Moleküle und hob auch hervor, dass beim Übergang der Elemente in den Gaszustand diese sich nur in Moleküle, welche noch aus mehreren einzelnen Atomen bestehen, nicht aber in Atome auflösen. Produkt-Highlight
Verschiedene Formulierungen des GesetzesGase bestehen aus Molekülen, im Falle der Edelgase jedoch aus Atomen. Wenn Atome und Moleküle als „kleinste Teilchen“ zusammengefasst werden, gilt: „Gleiche Volumina aller Gase enthalten bei gleicher Temperatur und gleichem Druck gleich viele kleinste Teilchen.“ „Die molare Gaskonstante hat für alle Gase denselben Wert.“ Aus den Gasgesetzen von Gay-Lussac und Boyle-Mariotte folgt für ein homogenes Gas, das heißt für eine Gassorte, für die Temperatur, Druck oder Volumen variiert wird:
Der Satz von Avogadro besagt nun, dass diese Konstante für alle Gase denselben Wert annimmt, es ist die universelle oder allgemeine Gaskonstante R.
Das ist nicht selbstverständlich, denn es bedeutet: Daraus folgt, dass die Gasgleichung für alle hinreichend verdünnten Gase gilt. Es ist eine allgemeine Gasgleichung, die insbesondere unabhängig von der Molekül- bzw. Molmasse gilt und damit stoffunabhängig ist. Eine unzureichende FormulierungBisweilen wird fälschlicherweise angenommen, das Avogadrosche Gesetz werde dadurch wiedergegeben, dass das Volumen der Stoffmenge proportional sei, V/n = const. Dies folgt zwar aus dem Gesetz von Avogadro, ergibt sich aber auch ganz einfach, wenn das Gas als homogen, also durch und durch gleichförmig angenommen wird. Aus dieser Annahme folgt sofort, dass zwei gleichgroße Volumen auch dieselbe Stoffmenge enthalten. Da die Beziehung V/n = const für ein homogenes Gas selbstverständlich ist, ist dies ein triviales, einfaches Gesetz. Avogadros Gesetz geht aber weit über diese Aussage hinaus, wie oben gezeigt wurde, und ist damit weder trivial noch offensichtlich. Anwendung des GesetzesEine wichtige Anwendung des Gesetzes ist die Bestimmung von Molekül- oder Molmassen (häufig nicht korrekt als „Molekulargewichte“ bezeichnet) durch Abwiegen eines bekannten Gasvolumens. BedeutungHistorische BedeutungAvogadros Ansichten gelangten erst fast ein halbes Jahrhundert nach ihrer ersten Formulierung zur Geltung. Man erkannte, dass diejenigen Molekülmassen, welche sich gemäß dem Avogadroschen Gesetz für die einzelnen Verbindungen ergaben, die Analogien derselben am besten hervortreten lassen und mit allen Eigenschaften derselben, chemischen wie physikalischen, am besten übereinstimmen, das heißt man erkannte, dass die mit diesem Gesetz gewonnenen Molmassen korrekt waren. Da die Molmassen von grundlegender Bedeutung sind, gewann man durch dieses Gesetz ein sicheres Fundament für den weiteren Ausbau der Chemie. Avogadros Gesetz war damit von großer Bedeutung, insbesondere für die Chemie im Allgemeinen. Es ist aber auch die Physik bedeutend, vor allem für die kinetische Gastheorie, welche von James Clerk Maxwell vollendet wurde. Heutige BedeutungHeutzutage werden Molmassen praktisch ausschließlich mit Hilfe des Massenspektrometers bestimmt, so dass das Gesetz heute keine direkte praktische Bedeutung mehr besitzt. Es hat aber einen sehr großen didaktischen Wert und ist in der idealen Gasgleichung – wenn auch versteckt – enthalten, welche natürlich auch heute unabdingbar ist. |
|
| Dieser Artikel basiert auf dem Artikel Avogadrosches_Gesetz aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |