Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
DissoziationskonstanteDie Dissoziationskonstante, abgekürzt Kd, ist in der Chemie ein Maß dafür, wo sich in einer Dissoziationsreaktion Produkt-Highlightein Gleichgewicht einstellt. Sie gibt an "auf welcher Seite" der Reaktion das Gleichgewicht liegt bzw. in welcher Form (dissoziiert oder undissoziiert) die Substanz bevorzugt vorliegt. Je größer Kd ist, desto weiter liegt das Gleichgewicht bei der dissoziierten Form. Die Dissoziationskonstante ist ein Spezialfall der Gleichgewichtskonstante aus dem Massenwirkungsgesetz. Bei Reaktionen in Lösungen ist die Dissoziationskonstante Kd, im thermodynamischen Sinne, praktisch nur von der Temperatur abhängig. Theoretisch wird sie auch vom Druck beeinflusst, was jedoch nur bei Gasen eine Rolle spielt. Für beide Reaktionen gibt es Geschwindigkeiten k1 für die Hinreaktion und k − 1 für die Rückreaktion. Sie wird wie folgt berechnet: [A], [B], und [AB] sind die Konzentrationen der Stoffe A, B, und AB in Mol pro Liter. Die Dissoziationskonstante wird auch in mol/L oder M angegeben. In der Pharmakologie typische Größenordnungen liegen im nM und µM-Bereich.
BeispieleWasserAls Beispiel die Kd und pKd-Werte von Wasser bei verschiedenen Temperaturen (pKd = -lg Kd):
Siehe auchpH-Wert | Massenwirkungsgesetz | pKs-Wert Kategorien: Chemische Größe | Säure-Base-Reaktion |
|||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Dissoziationskonstante aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


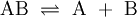



![K_d = {[A] \cdot [B] \over [AB]} = {k_{-1} \over k_1}](images/math/e/9/9/e99eb839ff37970ff5a0a0f5e6d07f01.png)
![K_d = {[H^+] \cdot [OH^-] \over [H_2O]}](images/math/4/9/b/49b1eb8af5be004a0ba3257424c40a51.png)
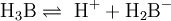
![\mathrm{K_1 = {[H^+] \cdot [H_2 B^-] \over [H_3 B]}}](images/math/5/f/4/5f4f6568a74831768236be9043fae87f.png)
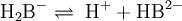
![\mathrm{K_2 = {[H^+] \cdot [H B ^{2-} ] \over [H_2 B^-]}}](images/math/5/7/0/5704925eff5b91378b3f5ed96eed5b2d.png)
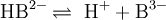
![\mathrm{K_3 = {[H^+] \cdot [ B^{3-}] \over [H B ^{2-} ]}}](images/math/9/a/d/9ada4a692c623b5de8349cd5d6b66ed3.png)


