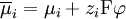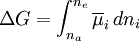Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Elektrochemisches PotentialDas elektrochemische Potential
Produkt-Highlight
(Unter den genannten Bedingungen ist die aufzubringende Arbeit gleich der Änderung der Gibbs-Energie ΔG des Systems. Vergleiche chemisches Potential.) Da jede Potentialdifferenz die Fähigkeit eines Systems beschreibt, Arbeit zu verrichten, laufen chemische Reaktionen unter Beteiligung von Ionen solange ab, bis sich die elektrochemischen Potentiale aller Systemkomponenten angeglichen haben. Die Betrachtung dieses Prinzips an Phasengrenzen, die für nur eine Ionensorte durchlässig sind, erklärt die Wirkungsweise der Glaselektrode als pH-Messgerät sowie die Ausbildung des Donnan-Potentials (nach Frederick George Donnan) an biologischen Membranen und führt zur Herleitung der Nernst-Gleichung. Das Konzept ist nicht auf Ionen beschränkt, sondern kann auf alle elektrisch geladenen Teilchen angewandt werden. So ist zum Beispiel die Fermienergie der Elektronen eines Festkörpers gleich ihrem elektrochemischen Potential. Die Angleichung der elektrochemischen Potentiale der Elektronen über die Kontaktfläche zwischen einem Metall und einem Halbleiter führt zur Ausbildung einer Schottky-Barriere, die in der Halbleitertechnik von Bedeutung ist. Das Potential E einer Elektrode ist zwar ein in der Elektrochemie besonders wichtiges Potential und hängt direkt vom hier behandelten elektrochemischen Potential Siehe auch: |
||||
| Dieser Artikel basiert auf dem Artikel Elektrochemisches_Potential aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


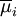 ist das
ist das 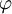 .
.