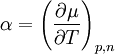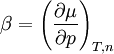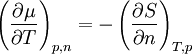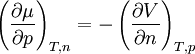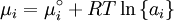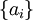Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Chemisches PotentialDas chemische Potential μ charakterisiert die Möglichkeiten eines Stoffes,
Eine Reaktion, Umwandlung oder Umverteilung kann freiwillig nur stattfinden, wenn das chemische Potential im Ausgangszustand größer ist als im Endzustand. Eine Reaktion läuft von selbst, wenn die Summe der μ-Werte der Ausgangsstoffe größer ist als die der Endstoffe; ein Stoff wechselt seine Kristallstruktur, seinen Aggregatzustand, seinen Assoziationsgrad etc. nur wenn der μ-Wert in der Ausgangsform größer ist als in der Endform; ein Stoff wandert nur in eine Richtung, in der der μ-Wert abnimmt (vorausgesetzt es existiert kein anderer Antrieb). Das chemische Potential ist damit geeignet zur Beschreibung aller Arten von stofflichen Umsetzungen, auch von Reaktionen, an denen Photonen, Phononen, Elektronen oder Defektelektronen beteiligt sind. Es ist definiert durch die Gibbs‘sche Fundamentalgleichung der inneren Energie U:
S = Entropie p = Druck V = Volumen ni = Stoffmenge der Systemkomponente i Die Größe μ, die wir heute chemisches Potential nennen, wurde eingeführt von Josiah Willard Gibbs (1839-1903). Er nannte sie Potential eines Stoffes; gelegentlich auch, um Verwechslungen mit anderen Potentialen zu vermeiden, intrinsisches Potential.
Produkt-Highlight
Alternative FormulierungenAus der Gibbschen Fundamentalgleichung folgt, dass μ aus der Funktion U(V, S, ni) berechnet werden kann:
Alternativ lässt sich μ auch aus Legendre-Transfomierten von U(V, S, ni) berechnen:
Hier ist H = U + pV die Enthalpie, F = U – TS die freie Energie und G = U + pV – TS die freie Enthalpie. Der Index gibt die konstant zu haltenden Größen an. Die nj sind die Stoffmengen aller Systemkomponenten außer ni
GleichgewichtsbedingungenIm chemischen Gleichgewicht ist das chemische Potential der Edukte gleich dem der Produkte, ähnlich wie im thermischen Gleichgewicht zwischen zwei Systemen deren Temperaturen gleich sind oder im elektrischen Gleichgewicht die elektrischen Potentiale. Bei geeigneter Prozessführung kann die Bedingung für chemisches Gleichgewicht auch als Extremalprinzip formuliert werden.
Da bei chemischen Reaktionen oft Druck und Temperatur konstant gehalten werden, ist das Minimalprinzip der freien Enthalpie G das am meisten verwendete Kriterium. Das allgemeinere Gleichgewichtskriterium ist aber das Verschwinden der chemischen Potenzialdifferenz, denn es gilt unabhängig davon, welche anderen Größen konstant gehalten werden; es gilt auch dann noch, wenn keine der anderen Variablen während des Einstellprozesses des Gleichgewichts konstant bleibt. Interpretationμi gibt die Abhängigkeit der thermodynamischen Energiegrößen U, H, F und G von der Zusammensetzung des Systems an. Jede Potentialdifferenz beschreibt die Fähigkeit des Systems, Arbeit zu verrichten. Daher besitzen chemische Reaktionen solange eine Triebkraft ("Freiwilligkeit des Ablaufens"), bis sich ein Gleichgewicht einstellt, indem sich die chemischen Potentiale aller Stoffe angleichen (Die Summe der chemischen Potentiale multipliziert mit den stöchiometrischen Koeffizienten ergibt Null, oder anders gesagt: die Affinität wird Null). Für reine Stoffe (einkomponentige Systeme) ist das chemische Potential konstant und gleich der molaren Gibbs-Energie. Die molaren Gibbs-Energien für die Bildung vieler Stoffe unter Standardbedingungen sind tabelliert und erlauben die Berechnung von chemischen Potentialdifferenzen in Reaktionsmischungen. Bei gegebenen p, T, V, S und nj = 1 Für kristalline Festkörper entspricht das chemische Potential der Elektronen bei T = 0 K der Fermi-Energie. Für Quasiteilchen gilt μ = 0, da für diese die Teilchenzahl nicht erhalten ist. Werte des chemischen PotentialsDie Werte des chemischen Potentials sind für Standardbedingungen (T = 298,15 K; p = 101,325 kPa) tabelliert, siehe unten unter „Weblinks“.
Ist das chemische Potential für einen bestimmten Zustand bekannt (z. B. bei Standardbedingungen), so lässt es sich für Drücke und Temperaturen in der Umgebung dieses Zustandes in linearer Näherung berechnen: der Temperaturkoeffizient und der Druckkoeffizient. und folgt, dass der Temperaturkoeffizient gleich der negativen molaren Entropie und der Druckkoeffizient gleich dem molaren Volumen ist.
KonzentrationsabhängigkeitZur praktischen Definition der Konzentrationsabhängigkeit wird das chemische Potential in einen konzentrationsunabhängigen und einen konzentrationsabhängigen Summanden aufgespalten. Die Definition des konzentrationsabhängigen Terms erfolgt mit Hilfe der thermodynamischen Aktivität der Komponente i:
(Die geschweiften Klammern sind hier als mathematischer Operator zu verstehen, der bedeutet: "Dividiere ai durch die Standardaktivität.") Die Aktivität kann in Berechnungen oft mit ausreichender Genauigkeit durch die Konzentration ci (für gelöste Stoffe) bzw. den Partialdruck pi (für Gase) ersetzt werden. Handelt es sich bei dem betrachteten System um einen Elektrolyten, so liefert die Debye-Hückel-Theorie einen Aktivitätskoeffizienten, mit dessen Hilfe sich die Konzentration in die Aktivität umrechnen lässt. Literatur
Siehe auchelektrochemisches Potential, Temperatur, Druck, Entropie, intensive Größe, Nernst-Gleichung |
|||||||||||||||
| Dieser Artikel basiert auf dem Artikel Chemisches_Potential aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


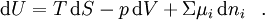



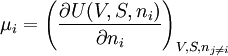
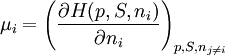
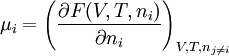
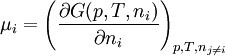
 k ist damit die Berechnung von Reaktionswärme und Reaktionsrichtung möglich.
k ist damit die Berechnung von Reaktionswärme und Reaktionsrichtung möglich.