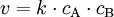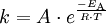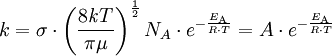Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
GeschwindigkeitskonstanteDie Geschwindigkeitskonstante hat das Symbol k. Sie wird in der Chemie verwendet, um die Proportionalität der Reaktionsgeschwindigkeit v zu den Konzentrationen zweier Stoffe A und B in der Gleichung Produkt-Highlightdarzustellen. In die Berechnung der Geschwindigkeitskonstanten k (nach der Arrhenius-Gleichung) gehen der Frequenzfaktor A (oder auch präexponentieller Faktor genannt), die Aktivierungsenergie EA (Einheit: J/mol), die universelle Gaskonstante R (= 8,314 J/(K mol)) und die absolute Temperatur T (in Kelvin K) ein: Die empirische Arrhenius-Gleichung geht davon aus, daß der Frequenzfaktor A nicht temperaturabhängig ist, was eine für die meisten Belange hinreichend genaue Näherung darstellt. Aus der Stoßtheorie leitet sich hingegen eine Gleichung ab, die die Temperaturabhängigkeit des Frequenzfaktors A berücksichtigt. Der Frequenzfaktor A entspricht dabei dem Produkt aus der Stoßzahl Z und dem Orientierungsfaktor P.
|
| Dieser Artikel basiert auf dem Artikel Geschwindigkeitskonstante aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |