Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
AktivierungsenergieDie Aktivierungsenergie ist die Energie, die erforderlich ist, um ein Teilchen (Molekül, Atom, Elektron, usw.) aus einem bestimmten Energieniveau (getrennte Energie) in ein höheres Energieniveau zu überführen, in dem das Teilchen eine zuvor nicht gegebene „Aktivität“ erhält. Produkt-Highlight
Reaktionskinetik
Die physikalische Chemie versteht unter der Aktivierungsenergie die Energiebarriere, die vom Reaktionskomplex überwunden werden muß, damit eine Reaktion ablaufen kann. Beim Zusammentreffen der Reaktionspartner verbinden sich diese vorübergehend zum aktivierten Komplex (der Bereich des Maximums in der Graphik auf der linken Seite). Je höher die Temperatur des Reaktionssystems, umso höher ist die Wahrscheinlichkeit, daß die Reaktanden die benötigte Aktivierungsenergie bereitstellen und zum Produkt weiterreagieren können. Der Zusammenhang zwischen Aktivierungsenergie und Temperatur wird quantitativ durch die Arrhenius-Gleichung beschrieben: Was die Aktivierungsenergie nicht istBestimmte vereinfachende, aber falsche Annahmen werden gerne wiederholt. Entgegen diesen Annahmen ist die Aktivierungsenergie
Tatsächlich beschreibt das Modell von Arrhenius die Vorgänge bei einer chemischen Reaktion nur unvollständig; der Faktor A ist eine rein empirische Größe, die ihrerseits wieder von der Temperatur abhängt. Für einige Reaktionen wurde eine negative Aktivierungsenergie gefunden, was physikalisch unmöglich scheint. Nach Eyring, (s.a. Theorie des Übergangszustandes) ist die Freie Aktivierungsenthalpie KatalyseEin (positiver) Katalysator setzt die Aktivierungsenergie für chemische Reaktionen herab, ändert jedoch nicht die freie Reaktionsenthalpie ΔRG. Man nimmt an, dass bei Anwesenheit eines Katalysators ein Komplex mit niedrigerer Aktivierungsenergie gebildet wird und so die Reaktionswahrscheinlichkeit steigt. Halbleiter
Siehe auchLiteratur |
|
| Dieser Artikel basiert auf dem Artikel Aktivierungsenergie aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





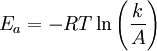
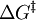 die bestimmende Größe für die Reaktionsgeschwindigkeit.
die bestimmende Größe für die Reaktionsgeschwindigkeit.


