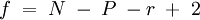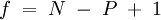Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Gibbssche PhasenregelDie Gibbssche Phasenregel (nach Josiah Willard Gibbs 1876) beinhaltet die Aussage, dass im thermodynamischen Gleichgewicht nicht beliebig viele Phasen gleichzeitig nebeneinander vorliegen können. Zudem kann man mit ihr die an einem bestimmten Punkt im Phasendiagramm maximal möglichen Freiheitsgrade bestimmen. Für ein physikalisch homogenes thermodynamisches System reichen zwei Zustandsgrößen zur Bestimmung des Gleichgewichtszustands aus. Produkt-HighlightFür Fluide, also Gase und Flüssigkeiten, lautet sie:
P = Anzahl der Phasen (z. B. die Aggregatzustände oder koexistierende flüssige Phasen (z.B. sind Wasser und Öl nicht mischbar und bilden zwei Phasen)) f = Anzahl der Freiheitsgrade r = Anzahl der unabhängigen Reaktionsgleichungen
Siehe auch: kritischer Punkt, Tripelpunkt, Phasengrenzlinie, Eulerscher Polyedersatz Kategorien: Thermodynamik | Werkstoffkunde |
| Dieser Artikel basiert auf dem Artikel Gibbssche_Phasenregel aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |