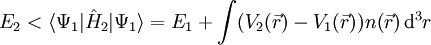Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Hohenberg-Kohn-TheoremDas Hohenberg-Kohn-Theorem (nach Walter Kohn und Pierre Hohenberg) besagt, dass es zu einem Potential Produkt-HighlightBeweis (reductio ad absurdum)Annahme: Grundzustand Ψ1 nicht entartet mit Hamiltonoperator Es gilt mit Zu widerlegende Behauptung: Es gibt ein Potential
Dabei ist Ψ2 die Grundzustandswellenfunktion zum Hamiltonoperator Analog ergibt sich:
Durch Addition der beiden Ungleichungen folgt: E1 + E2 < E1 + E2 Die Annahme war also falsch und das Hohenberg-Kohn-Theorem damit bewiesen. Literatur
Kategorien: Quantenmechanik | Theoretische Chemie |
| Dieser Artikel basiert auf dem Artikel Hohenberg-Kohn-Theorem aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


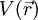 im
im 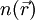 gibt.
Dadurch ergibt sich eine Vereinfachung, da man statt mit 3N Variablen nur noch mit 3 Variablen rechnen muss.
Das Hohenberg-Kohn-Theorem ist eine wichtige Grundlage der
gibt.
Dadurch ergibt sich eine Vereinfachung, da man statt mit 3N Variablen nur noch mit 3 Variablen rechnen muss.
Das Hohenberg-Kohn-Theorem ist eine wichtige Grundlage der 


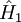 und Potential
und Potential 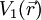
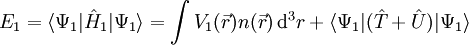
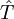 : kinetische Energie,
: kinetische Energie, 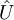 beschreibt die Wechselwirkung der Elektronen
beschreibt die Wechselwirkung der Elektronen
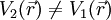 , das zur selben Dichte führt.
, das zur selben Dichte führt.
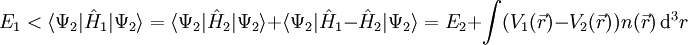
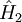 .
.