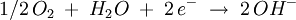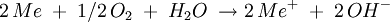Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
SauerstoffkorrosionBei der Sauerstoffkorrosion reagieren die in der Elektrolytlösung gelösten Sauerstoffmoleküle mit Wasser zu Hydroxid-Ionen, die dann mit dem Metall Oxide und Hydroxide bilden können. Das Rosten von Eisen ist beispielsweise eine Sauerstoff-Korrosion. Produkt-HighlightUnter interkristalliner Korrosion versteht man Kornzerfall, der bei nichtrostenden Stählen im Temperaturbereich von 400 bis 800 °C eintreten kann. Durch eine Temperaturerhöhung wie z. B. durch Schweißen etc. scheiden sich Chromcarbide oder -nitride auf den Korngrenzen aus. Die Matrix verarmt an Chrom und die Korrosionsbeständigkeit geht verloren. Der Kristallverband wird zerstört. Voraussetzung für die Sauerstoff-Korrosion:
AblaufDer chemische Ablauf der Korrosion durch Sauerstoffkorrosion eines metallischen Werkstoffes erfolgt unter Einwirkung bzw. Verbrauch von Sauerstoff, d.h. der Sauerstoff wirkt als Oxidationsmittel. Dieser Mechanismus läuft vornehmlich in alkalischen und neutralen Lösungen. Die Reduktion des Sauerstoffs kann mit folgender Formel beschrieben werden: Beschreibung der Summenreaktion für ein einwertiges Metall: Das typische Beispiel ist das Rosten von Eisen. Dieser Begriff, genauso wie der der Wasserstoffkorrosion, sind allerdings veraltet. |
| Dieser Artikel basiert auf dem Artikel Sauerstoffkorrosion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |