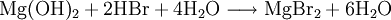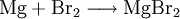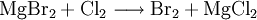Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Magnesiumbromid
Magnesiumbromid ist eine chemische Verbindung des Magnesiums aus der Gruppe der Bromide. Es ist ein farbloses, hygroskopisches Pulver und tritt auch als Hexahydrat auf, welches bei 165 °C zu Magnesiumbromid dehydratisiert. Produkt-Highlight
VorkommenMagnesiumbromid kommt natürlich in Abraumsalzen von Kalisalzlagerstätten (Bromide kommen in Kalisalzen etwa im Verhältnis von 1:300 zu den analogen Chloriden vor) und im Meerwasser (in einer Konzentration von etwa 70g/m³) vor[4]. Gewinnung und DarstellungEs existieren verschiedene Möglichkeiten zur Herstellung von Magnesiumbromid, darunter:
EigenschaftenPhysikalische EigenschaftenMagnesiumbromid besitzt eine Cadmiumiodid-Kristallstruktur. VerwendungMagnesiumbromid kann zur Herstellung von Brom aus bromidhaltigen Laugen verwendet werden. Weiterhin wird es bei organischen Synthesen eingesetzt[5]. Quellen
Literatur
Kategorien: Reizender Stoff | Bromid | Magnesiumverbindung |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Magnesiumbromid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||