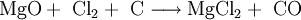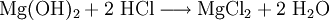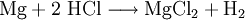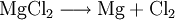Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Magnesiumchlorid
Magnesiumchlorid, MgCl2, ist das Magnesiumsalz der Salzsäure. Es bildet mehrere Hydrate. Produkt-Highlight
VorkommenMagnesiumchlorid kommt in der Natur im Mineral Carnallit (KMgCl3 · 6 H20) als Doppelsalz vor. Eine weitere natürliche Quelle ist das Meerwasser. Dort ist es nach Natriumchlorid das häufigste Salz. Gewinnung und DarstellungDie technische Gewinnung von Magnesiumchlorid erfolgt durch Eindampfen der Endlaugen aus der Produktion von Kaliumchlorid. Dabei wird zuerst das Magnesiumchlorid-Hexahydrat (MgCl2 · 6H2O) erhalten. Weiteres Eindampfen liefert ein wasserärmeres Produkt. Wasserfreies Magnesiumchlorid wird durch Umsetzung von Magnesiumoxid mit Koks und Chlor gewonnen: Im Labor kann Magnesiumchlorid aus Magnesiumhydroxid und Salzsäure oder durch Umsetzung von Magnesium mit Salzsäure gewonnen werden. EigenschaftenMagnesiumchlorid ist stark hygroskopisch. Seine Neigung zur Hydrolyse ist weniger ausgeprägt als beim Aluminiumchlorid (AlCl3). Wasserfreies Magnesiumchlorid kristallisiert im CdCl2-Gittertyp. Magnesiumchlorid-Hexahydrat (CAS-Nummer: 7791−18−6) besitzt eine molare Masse von 203,3 g·mol–1, eine Dichte von 1,57 g·cm–3 und einen Schmelzpunkt von ca. 117 °C (Zersetzung).[1] Die Löslichkeit des Hexahydrates beträgt 1700 g/L (bei 20 °C). VerwendungMagnesiumchlorid wird zur Gewinnung von elementarem Magnesium mittels Schmelzflusselektrolyse genutzt: Es wird zusammen mit Magnesiumoxid in Estrichzementen verwendet, als Streusalz und als Lebensmittelzusatzstoff mit der Kennzeichnung (E-Nummer) E 511. Es dient als künstlicher Geschmacksverstärker und ist für Öko-Lebensmittel zugelassen. Des Weiteren wird Magnesiumchlorid zur Anhebung der Magnesiumkonzentration in Riffaquarien verwendet. QuellenKategorien: Magnesiumverbindung | Chlorid |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Magnesiumchlorid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||||