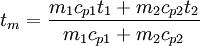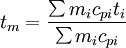Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
MischtemperaturMischtemperatur (mit spezifischer Wärmekapazität). - Stoffthermodynamik (engl. Mixing temperature with use of the specific heat capacities) Produkt-HighlightMischt man bei konstantem Druck und unter Vernachlässigung äußerer Wärmeeinwirkungen zwei Stoffe (Massen m1 und m2) mit den Temperaturen t1 und t2, so stellt sich ein thermisches Gleichgewicht ein. Das heißt, vom wärmeren Stoff wird solange Energie auf den kälteren übertragen, bis beide die gleiche Temperatur tm erreichen (Mischtemperatur). Für die Energien gilt also:
oder
wobei cp1 und cp2 die spezifischen Wärmekapazitäten der beiden Stoffe sind. Einheiten: Masse m (in kg), Temperatur t (in °C oder K), spez. Wärmekapazität cp (in kJ/kgK). Daraus ergibt sich für die Mischtemperatur:
|
| Dieser Artikel basiert auf dem Artikel Mischtemperatur aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |