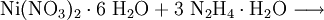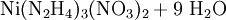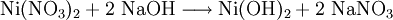Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Nickel(II)-nitrat
Nickel(II)-nitrat ist eine chemische Verbindung des Metalls Nickel aus der Gruppe der Nitrate. Sie kommt gewöhnlich in Form ihres Hexahydrates Ni(NO3)2•6H2O vor, weshalb sich alle Angaben aus der Tabelle auf dieses beziehen. Produkt-Highlight
Chemische EigenschaftenNickel(II)-nitrat ist ein starker Oxidator und kommt in verschiedenen Hydratformen vor. Am häufigsten ist Hexahydrat (Ni(NO3)2•6H2O). Beim langsamen Erhitzen des Nickel(II)-nitrat Hexahydrats bildet sich ab 45 °C das Tetrahydrat ((Ni(NO3)2•4H2O)), ab 80 Grad C das Dihydrat (Ni(NO3)2•2H2O), bei 120 bis 145 °C basisches Nickelnitrat. Beim abkühlen kann sich Nonahydrat bilden (Ni(NO3)2•9H2O). Oberhalb von 200 °C beginnt sich Nickelnitrat zu Nickel(II)-oxid zu zersetzen. Beim raschen Erhitzen erfolgt zwischen 310 und 340 °C Zersetzung zu Nickel(II)-oxid, Stickoxiden und Sauerstoff. Durch Reaktion von Nickelnitrat-Hexahydrat mit Hydrazin-hydrat kann Nickelhydrazinnitrat gewonnen werden. Durch Reaktion von Nickelnitrat mit Natriumhydroxid entsteht Nickel(II)-hydroxid VerwendungNickel(II)-nitrat verwendet man in der Keramikindustrie (als braunes Pigment), in der Färberei als Beizmittel, zum elektrolytischen Vernickeln, zum Gewinnen von Nickeloxid und zum Herstellen von reinem Katalysatornickel. SicherheitshinweiseNickel(II)-nitrat wirkt brandfördernd und ist als krebserzeugend eingestuft. Quellen
Kategorien: Giftiger Stoff | Brandfördernder Stoff | Nickelverbindung | Nitrat |
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Nickel(II)-nitrat aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||