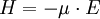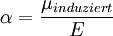Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
PolarisierbarkeitDie Polarisierbarkeit ist eine Eigenschaft chemischer Moleküle. Sie beschreibt die Fähigkeit eines Moleküls auf ein elektrisches Feld zu reagieren. Das Molekül nimmt dabei ein elektrisches Dipolmoment an. Die Wellenfunktion des Moleküls wird also durch die Annäherung einer externen Ladung gestört. Produkt-Highlight
wobei H die Störung, μ das induzierte Dipolmoment und E das elektrische Feld bezeichnen. Die Polarisierbarkeit α selbst ist definiert durch
Je höher also die Polarisierbarkeit ist, desto leichter lässt sich ein Dipolmoment induzieren. Das elektrische Feld kann verschiedene Ursachen haben. Es kann von äußeren Elektroden herkommen oder auch von einem anderen Molekül. Die Polarisierbarkeit wirkt sich auf viele Eigenschaften des Moleküls aus, zum Beispiel die Brechzahl und die optische Aktivität. Auch die Eigenschaften von Flüssigkeiten und Feststoffen (also Ansammlungen vieler Moleküle) werden durch die Polarisierbarkeit mitbestimmt, siehe London-Kraft. Kategorien: Physikalische Chemie | Atomphysik |
| Dieser Artikel basiert auf dem Artikel Polarisierbarkeit aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |