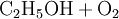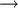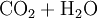Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
SymbolschreibweiseIm Periodensystem der Elemente (PSE) werden alle Stoffe mit Kürzeln, mit Atomsymbolen angegeben, wie zum Beispiel Natrium = Na, Kohlenstoff = C (vom lateinischen Wort carboneum) oder Sauerstoff = O (lateinisch oxygenium). Die Symbole leiten sich entweder von den alten lateinischen oder griechischen Namen der Elemente ab oder bei den neueren Elementen von den englischen Namen ab. Besteht ein Symbol aus zwei Buchstaben so wird immer der erste Buchstabe groß und der zweite Buchstabe klein geschrieben. Beispiele für die Groß- und Klein-Schreibung von Element-Symbolen
Produkt-Highlight
Verbindungen in SymbolschreibweiseDiese Atomsymbole werden auch benutzt um Verbindungen von Atomen auszudrücken. Dazu werden die Symbole aller in der Verbindung enthaltenen Elemente und deren Anzahl angegeben. Die Anzahl der einzelnen Atome wird durch einen Index (kleine, tiefergestellte Zahl hinter dem Symbol) angegeben. Die Zahl "1" als Index wird fast immer weggelassen. Beispiele für die Symbolschreibweise wichtiger Verbindungen:
Man liest die Symbolschreibweise vor, indem man die einzelnen Buchstaben und die Zahlen nacheinander ausspricht:
Die Reihenfolge der Atomsymbole in den Formeln der Verbindungen richtet sich nach der Stellung im Periodensystem: Das Atomsymbol, das weiter links steht, ist das Erstgenannte, sobald Atomsymbole untereinander stehen, wird das untere zuerst genannt. Ausnahmen gibt es beim Wasserstoff, wenn er sich mit Stickstoff oder Kohlenstoff verbindet. Beispiele bei denen Wasserstoff hinten steht:
Benennung von VerbindungenNeben den sogenannten Trivialnamen, die viele bekannte Verbindungen haben (siehe Beispiele oben), gibt es auch eine systematische Benennung (Nomenklatur) von Verbindungen, die sich aus der Symbolschreibweise ergibt. Die systematische Benennung von Verbindungen ergibt sich aus den Namen der beteiligten Elementen, unter Verwendung von Zahlwörtern. Sie heißen der Reihe nach: Mono-, Di-, Tri-, Tetra-, Penta-, Hexa-, Hepta-, Okta-, Nona-, Deka-, und so weiter. So heißt As2O5 beispielsweise in Worten Diarsenpent(a)oxid. Das Element, das hinten steht, wird oft mit der Endung -id angegeben; teilweise unter Verwendung des lat./griech. Namens. Beispiele für Endungen:
Verbindungen mit drei oder mehr Elementen haben meist Trivialnamen. Beispiele für systematische Benennungen:
Mehrere TeilchenHat man mehrere Teilchen einer Verbindung, so kann man dies auch mit der Symbolschreibweise schreiben, indem man vor die Formel eine Zahl (den sogenannten Koeffizienten) schreibt. Zum Beispiel bedeutet 4 H2O: 4 Wasserteilchen = 8 Wasserstoffatome und 4 Sauerstoffatome (denn die 4 bezieht sich auf die ganze Verbindung). Arten von VerbindungenJe nach Art der Verbindung kann die Symbolschreibweise einer Verbindung verschiedene Bedeutungen haben:
Reaktionsgleichungen in SymbolschreibweiseSymbole werden auch benutzt um Reaktionsgleichungen aufzustellen. Reaktionsgleichungen beschreiben chemische Vorgänge, die man beispielsweise in der Natur beobachtet oder absichtlich im Labor herbeiführt. Im folgenden Beispiel wird die Verbrennung von Alkohol (Ethanol) mit Sauerstoff zu Kohlendioxid und Wasser beschrieben: Statt der Wortgleichung: schreibt man in Symbolschreibweise: 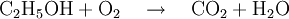 Allerdings liefert eine Reaktionsgleichung nicht nur qualitative (was?) Informationen über die Reaktion. Auch quantitative (wieviel?) Informationen sind enthalten. Da das Gesetz von der Erhaltung der Masse gilt, muss die Masse der Ausgangsstoffe gleich der Masse der Endprodukte sein. Diese Gleichheit ist hier noch nicht vorhanden, was man daran erkennt, dass die Anzahl der Atome jedes beteiligten Elementes auf beiden Seiten der Reaktionsgleichung nicht übereinstimmen.
Nach Ausgleichen der Reaktionsgleichung, mit Hilfe von stöchiometrischen Faktoren (oder auch Koeffizienten), lautet es dann: 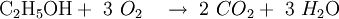 Die Zahlen, die in den Formeln (zum Beispiel H2O) tiefgestellt vorkommen, nennt man Indexzahlen. Diese beziehen sich auf das chemische Element davor und geben an, wieviele Atome davon in dem Molekül vorhanden sind. Ist die Formel eines Stoffes bekannt oder aufgestellt worden, so darf man diese Zahlen nicht mehr ändern, denn andere Zahlen würden neue Stoffe angeben. Die Zahlen, die im Formelschema vor den chemischen Formeln vorkommen, nennt man Koeffizienten. Diese geben die Anzahl der Möleküle des jeweiligen Stoffes an und dürfen für die Ausgleichsrechnung verändert werden. Was man auch wissen mussNeben den Formeln von wichtigen Verbindungen (wie Wasser) muss man auch folgendes wissen: Wichtig ist auch, ob eine Zahl davor steht (stöchiometrischer Koeffizient) oder unten (als Index) verwendet wird:
|
||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Symbolschreibweise aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |