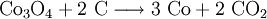Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Cobalt
Cobalt (fachsprachlich; standardsprachlich Kobalt) (von lat. cobaltum Kobold) ist ein chemisches Element mit dem Symbol Co und der Ordnungszahl 27. Cobalt ist ein ferromagnetisches Schwermetall aus der 9. Gruppe (früher 8. Nebengruppe) des Periodensystems der Elemente. Es zählt zu den Übergangsmetallen. 1735 entdeckte der schwedische Chemiker Georg Brandt das bis dahin unbekannte Element und gab ihm seinen Namen. Eine Besonderheit der molaren Masse von Cobalt ist, dass sie größer als die des nächsten Elementes im Periodensystem (Nickel) ist. Produkt-Highlight
GeschichteCobaltverbindungen sind schon seit sehr langer Zeit bekannt und wurden vorwiegend zum Färben von Glas und Keramik verwendet (Cobaltblau). Cobalterze sind schon seit langer Zeit bekannt. Im Mittelalter wurden sie häufig für wertvolle Silber- und Kupfererze gehalten. Da sie sich aber nicht verarbeiten ließen und wegen des Arsengehaltes beim Erhitzen schlechte Gerüche abgaben, wurden sie als verhext angesehen. Angeblich hätten Kobolde das kostbare Silber aufgefressen und an seiner Stelle wertlosere silberfarbene Erze ausgeschieden. Neben Cobalt waren dies auch Wolfram- und Nickelerze. Diese Erze wurden von den Bergleuten dann mit Spottnamen wie Nickel, Wolfram (etwa „Wolfsspucke“, lat. lupi spuma) und eben Kobolderz, also Cobalt belegt[1]. Erstmal dargestellt wurde Cobalt 1735 vom schwedischen Chemiker Georg Brandt. VorkommenCobalt ist ein seltenes Element mit einer Häufigkeit in der Erdkruste von ca. 0,003 %.[2]. Damit steht es in der Liste der nach Häufigkeit geordneten Elemente an 30. Stelle[3]. Elementar kommt es nur äußerst selten im Meteoriten, sowie im Erdkern vor. In vielen Mineralen ist Cobalt vertreten, kommt jedoch meist nur in geringen Mengen vor. Das Element ist stets mit Nickel, häufig auch mit Kupfer, Silber, Eisen oder Uran vergesellschaftet. Nickel ist dabei etwa drei- bis viermal so häufig wie Cobalt. Beide Elemente sind chalkophil (schwefelliebend) und für basische und ultrabasische Magmatite charakteristisch. Es gibt eine Reihe Cobalterze, in denen sich das Cobalt durch Verwitterung oder andere Prozesse angereichert hat. Die wichtigsten sind: Cobaltit (veraltet Kobaltglanz; CoAsS), Linneit und Siegenit (veraltet und irreführend Kobaltnickelkies [4]), (Co,Ni)3S4), Erythrin (veraltet Kobaltblüte), Asbolan (veraltet Erdkobalt), Skutterudit (Speiskobalt, Smaltin, CoAs3) und Heterogenit (CoOOH). Der Cobaltgehalt der sulfidischen Erze ist aber gering (meist nur 0,1−0,3 %[2]). Wichtige Erzlagerstätten befinden sich in Kanada, Sambia, Marokko, Demokratische Republik Kongo, Kuba, Russland, Australien und in den USA. Cobalt findet sich als Spurenelement in den meisten Böden. Die Staaten mit der größten Förderung
Die Staaten mit der größten Förderung sind die Demokratische Republik Kongo (24,1 % Weltmarktanteil im Jahre 2003), Sambia (22,7 %), Australien (13,9 %), Russland (9,7 %) und Kanada (8,7 %)
Gewinnung und DarstellungCobalt wird überwiegend aus Kupfer- und Nickelerzen gewonnen. Die genaue Gewinnungsart ist von der Zusammensetzung des Ausgangserzes abhängig. Zunächst wird ein Teil des vorhandenen Eisensulfids durch Rösten in Eisenoxid umgewandelt und mit Siliciumdioxid als Eisensilicat verschlackt. Es entsteht der sogenannte Rohstein, der neben Cobalt noch Nickel, Kupfer und weiteres Eisen als Sulfid oder Arsenid enthält. Durch weiteres Abrösten mit Natriumcarbonat und Natriumnitrat wird weiterer Schwefel entfernt. Dabei bildet sich aus einem Teil des Schwefels und Arsens Sulfate und Arsenate, die mit Wasser ausgelaugt werden. Es bleiben die entsprechenden Metalloxide zurück, die mit Schwefel- oder Salzsäure behandelt werden. Dabei löst sich nur Kupfer nicht, während Nickel, Cobalt und Eisen in Lösung gehen. Mit Chlorkalk kann anschließend selektiv Cobalt als Cobalthydroxid ausgefällt und damit abgetrennt werden. Durch Erhitzen wird dieses in Cobalt(II,III)-oxid (Co3O4) umgewandelt und anschließend mit Koks oder Aluminiumpulver zu Cobalt reduziert: EigenschaftenPhysikalische EigenschaftenCobalt ist ein stahlgraues, sehr zähes Schwermetall mit einer Dichte von 8,9 g/cm3[6]. Es ist ferromagnetisch mit einer Curie-Temperatur von 1150 °C[6]. Cobalt tritt in zwei Modifikationen, α-Cobalt mit einem hexagonal-dichtesten und β-Cobalt in einer kubisch-flächenzentrierten Kugelpackung, auf. Als typisches Metall leitet es Wärme und Strom (elektrische Leitfähigkeit 26 % von der des Kupfers[2]). Chemische EigenschaftenIm chemischen Verhalten ist es dem Eisen und Nickel ähnlich, an der Luft durch Passivierung beständig; es wird nur von oxidierend wirkenden Säuren gelöst. Cobalt zählt mit einem Normalpotential von −0,277 V zu den unedlen Elementen. In Verbindungen kommt es vorwiegend in den Oxidationsstufen +II und +III vor, bekannt sind aber andere von +I bis +V. Dabei ist die Oxidationsstufe +II in Verbindungen am stabilsten. Cobalt bildet eine Vielzahl von – meist farbigen – Komplexen. Darin ist die Oxidationsstufe +III häufiger und stabiler. AnwendungenAls Legierungsbestandteil zur Erhöhung der Verschleiß- und Warmfestigkeit von legierten und hochlegierten Stählen und Superlegierungen, als Binderphase in Hartmetall-Sinterwerkstoffen und Diamantwerkzeugen, als Oxid, Sulfat, Hydroxid oder Carbonat in hitzefesten Farben und Pigmenten (z. B. für die Bemalung von Porzellan und Keramik), als Bestandteil von magnetischen Legierungen, als Acetat in Trocknern für Farben und Lacke, als Katalysator (Entschwefelung/Hydrierung), als Hydroxid oder Lithium-Cobalt-Oxid (LiCoO2) in Batterien, in korrosions- bzw. verschleißfesten Legierungen und als Spurenelement für Medizin und Landwirtschaft. Seine Verwendung als Legierungselement und in Cobaltverbindungen macht es zu einem strategisch wichtigen Metall. Das radioaktive Isotop 60Co dient als Gamma-Strahler – für Krebstherapie („Kobaltkanone“), Sterilisation, Konservierung, Durchstrahlungsprüfung, etc. Eine mögliche militärische Anwendung wäre die Cobaltbombe als sogenannte „schmutzige Bombe“, die große Flächen verstrahlen würde. PhysiologieCobalt ist für die menschliche Ernährung ein essentielles Spurenelement als Bestandteil von Vitamin B12 (Cobalamin), welches beim gesunden Menschen von den Darmbakterien direkt aus Cobalt-Ionen gebildet werden kann. Die benötigte Cobaltmenge ist extrem gering, nur etwa 0,2 Mikrogramm pro Tag. Während kleine Überdosen von Co-Verbindungen für den Menschen nur wenig giftig sind, führen größere Überdosen (ab etwa 25–30 Milligramm pro Tag) zu Haut-, Lungen-, Magenerkrankungen, Leber-, Herz-, Nierenschäden und Krebsgeschwüren. Als man in Kanada früher Biere zur Schaumstabilisierung mit Cobalt anreicherte, stieg die Mortalitätsrate bei starken Biertrinkern auf annähernd 50% an – bedingt durch Herzmuskelschwäche („kanadisches Biertrinkerherz“). Heute wird dem Bier jedoch kein Cobalt mehr zugesetzt. [7] NachweisEine relativ aussagekräftige Vorprobe für Cobalt ist die Phosphorsalzperle, die von Cobaltionen intensiv blau gefärbt wird. Im Kationentrennungsgang kann es neben Nickel mit Thiocyanat und Amylalkohol nachgewiesen werden, es bildet beim Lösen im Amylalkohol blaues Co(SCN)2. Quantitativ kann Cobalt mit EDTA in einer komplexometrischen Titration gegen Murexid als Indikator bestimmt werden. VerbindungenCobalt tritt in seinen Verbindungen meist zwei- oder dreiwertig auf; diese Verbindungen besitzen oft kräftige Farben. Wichtige Cobaltverbindungen:
Siehe auchQuellen
Literatur
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Cobalt aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||