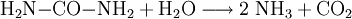Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Urease
Die Urease ist ein Enzym, das Harnstoff in Kohlenstoffdioxid und Ammoniak spaltet: Produkt-HighlightUrease kommt besonders in Pflanzensamen, Bakterien, Krebsen und Meeres-Muscheln vor. Insbesondere die Ureasen der Bodenbakterien spielen eine wichtige Rolle im Stickstoffkreislauf, denn ohne sie wäre eine Stickstoffdüngung durch den in Abwesenheit von Enzymen sehr hydrolysebeständigen Harnstoff, eines Bestandteils der Jauche, nicht möglich. Durch die Katalyseaktivität des Enzyms wird die Reaktionsgeschwindigkeit sehr stark um den Faktor 1014 erhöht. Die Urease aus Bohnen (und wohl auch der Bakterien) ist ein Metalloenzym und enthält Nickel. Die Urease aus Schwertbohnen war eines der ersten Enzyme überhaupt, die um das Jahr 1930 durch James Batcheller Sumner gereinigt und kristallisiert werden konnten. Urease wird auf Grund der Struktur des nickelhaltigen Zentrums in der metallorganischen Chemie als ein mögliches Modellsystem für die katalytische Aktivierung von Kohlenstoffdioxid angesehen. Komplexe N-Carbamate (Bindung des elektronenarmen Kohlenstoffatoms des Kohlenstoffdioxids an das elektronenreiche Stickstoffatom von Iminen/Aminen) mit Nickel (0- oder 2-wertig) als Zentralatom existieren und sind strukturell charakterisiert; infrarotspektroskopische Untersuchungen haben eine Energieabsenkung (Aktivierung) der thermodynamisch sehr stabilen C=O-Doppelbindungen nachweisen können. Jedoch steht der Nachweis der Übertragung von derartig „aktiviertem“ Kohlenstoffdioxid auf andere Substrate noch aus. |
||||||||||||
| Dieser Artikel basiert auf dem Artikel Urease aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||