Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Zink-Braunstein-ZelleDie Zink-Braunstein-Zelle, auch Leclanché-Element (nach Georges Leclanché), Trockenelement, Zink-Kohle-Element (wegen der Verwendung einer festen Kohle-Elektrode) oder Zink-Kohle-Trockenbatterie (wegen der gasdichten Kapselung der Zelle und der Eindickung des Elektrolyten), ist ein galvanisches Element und erzeugt elektrische aus chemischer Energie. Sie zählt zu den Primärelementen, da sie, anders als Akkumulatoren, nicht wiederaufladbar ist. Zink-Braunstein-Zellen sind preiswert in der Herstellung und waren verbreitet, sind aber mittlerweile durch die weitaus leistungsfähigeren und betriebssicheren Alkali-Mangan-Batterien verdrängt worden. Produkt-Highlight
AufbauDas Zink-Kohle-Element besteht aus einer Zinkelektrode (Anode (-)) und Braunsteinpulver (Katode (+)) mit einer Kohleelektrode als elektrischer Zuleitung. Als Elektrolyt wird dabei eine 20%ige Ammoniumchloridlösung eingesetzt. Der Verbraucher wird zwischen die beiden Elektroden geschaltet. Die Zelle liefert eine Spannung von in etwa 1,5 Volt. Im Bild erkennt man außen die Metall-Ummantelung. Sie erhöht die mechanische Stabilität der Zelle. Die Kunststoff-Folie unter dem Metall-Mantel soll ein Auslaufen der Zelle verhindern. Der Zink-Becher, der das Elektrolyt und den Braunstein umschließt, ist nahezu aufgebraucht und auf der Abbildung nicht zu erkennen. Der Kohlestift in der Mitte wurde, zusammen mit dem Plus-Außenkontakt der Batterie, etwas herausgezogen. ProblemeKommt es zum Auslaufen des Elektrolyten, dann zerfrisst er die Batterieanschlüsse des betroffenen Gerätes und beim Einlegen in das Gerät auch die Leiterbahnen und Lötstellen. Aus diesem Grund soll man diese Batterien bei teureren Geräten oder bei solchen, in denen sie länger verbleiben, nicht verwenden . Zudem besteht bei dem Leclanché-Element das Problem, dass ein schwerlöslicher Zinkkomplex (Diamminzinkchlorid) ausfällt. Dieser feste Komplex setzt sich an den Elektroden des Elementes ab und der elektrische Widerstand wird erhöht. Folglich sinkt die Leistung der Batterie schnell. ReaktionMinuspol (Anode): Pluspol (Kathode): Nachlieferung der nötigen Oxonium-Ionen aus dem Ammoniumchlorid-Elektrolyten: Die entstandenen Ammoniakmoleküle werden von den Zinkionen komplex gebunden: Die Reaktion dieses Komplexes mit den Chloridionen aus dem Ammoniumchlorid:
|
| Dieser Artikel basiert auf dem Artikel Zink-Braunstein-Zelle aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





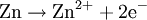
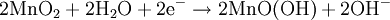
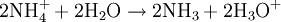
![\mathrm{ Zn^{2+} + 2NH_3 \rightarrow [Zn(NH_3)_2]^{2+} }](images/math/b/8/f/b8fb5805463c605c2c441ad4971cb232.png)
![\mathrm{ [Zn(NH_3)_2]^{2+} + 2Cl^- \rightarrow [Zn(NH_3)_2]Cl_2 }](images/math/0/3/3/033bf0068a8f746ed86052ea43962881.png)
![\mathrm{ Zn + 2MnO_2 + 2NH_4Cl \rightarrow 2MnO(OH) + [Zn(NH_3)_2]Cl_2 }](images/math/f/b/5/fb58260a4e23782f752e4d44a1c2176c.png)


