Bindung eines zweiten CO-Moleküls beobachtet
Forscher klären weiteren Schritt im Mechanismus der Reduktion von Kohlenmonoxid durch Nitrogenase auf
Anzeigen
Dank der biologischen Fixierung des Elements Stickstoff durch das Enzym Nitrogenase erhalten Organismen Zugriff auf den Stickstoff (N2) in der Erdatmosphäre, den sie nutzen, um zelluläre Strukturen aufzubauen. Zudem kann eine Vanadium-abhängige Variante der Nitrogenase das giftige Gas Kohlenmonoxid (CO) zu Kohlenwasserstoffen reduzieren. Diese Reduktionen von N2 und CO gehören in der industriellen Chemie zu den wichtigsten Verfahren, da sie für die Produktion sowohl von Düngemitteln als auch von synthetischen Kraftstoffen eingesetzt werden. Forschende konnten bisher jedoch nicht den unterschiedlichen Verlauf beider Reaktionen entschlüsseln. Dr. Michael Rohde aus dem Team von Prof. Dr. Oliver Einsle vom Institut für Biochemie der Universität Freiburg konnte nun in Zusammenarbeit mit zwei Arbeitsgruppen der Freien Universität Berlin zeigen, wie das Aktivzentrum der Vanadium-abhängigen Nitrogenase in der Lage ist, zwei CO-Moleküle gleichzeitig zu binden und dadurch die Basis zu schaffen, die räumlich benachbarten Kohlenstoffatome beider Moleküle in einem reduktiven Prozess zu verbinden.
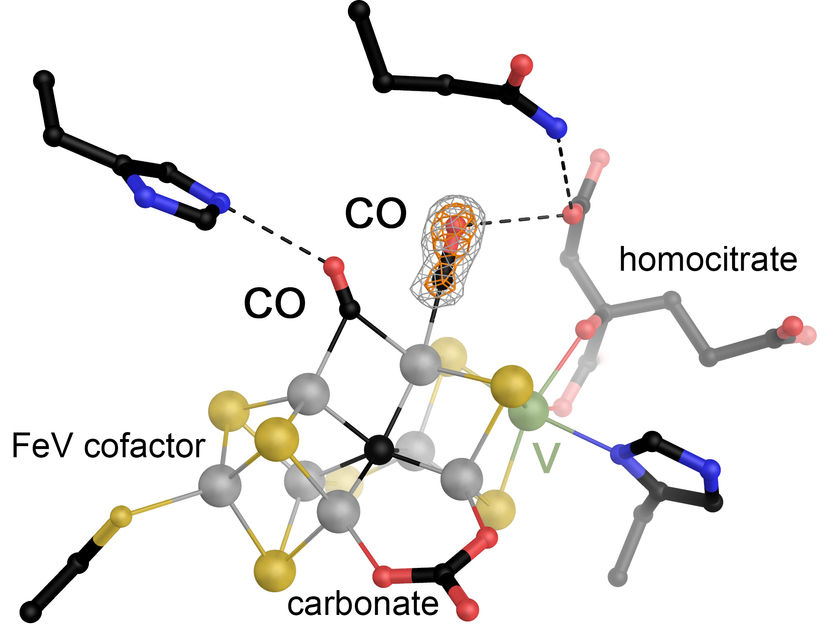
Der Eisen-Vanadium (FeV)-Cofaktor in der Vanadium-abhängigen Nitrogenase wurde mit Kohlenmonoxid (CO) umgesetzt und dann unter Druck begast, so dass zwei Moleküle des Substrats in gebundener Form dargestellt werden konnten. FeV-Cofaktor ist eines der größten und komplexesten Metallzentren in Proteinen, die derzeit bekannt sind. Er besteht aus sieben Eisenionen (grau), 9 Schwefelionen (gelb), einem zentralen Kohlenstoff (schwarz) und einem Vanadiumion (grün) und trägt zusätzlich als organische Liganden ein Carbonation und ein Molekül Homocitrat.
Oliver Einsle
Unterschiedliche Reaktionen der Nitrogenase
Die industriell durchgeführten Reduktionen von N2 und CO – als Haber-Bosch- beziehungsweise Fischer-Tropsch-Verfahren bezeichnet – laufen unter hohen Temperaturen und Druck ab. Während die N2-Reduktion zu dem bioverfügbaren Produkt Ammonium (NH4+) führt, verbinden sich bei der Umsetzung von CO mindestens zwei Kohlenstoffatome miteinander. Das überwiegende Reaktionsprodukt ist Ethylen (Ethen, C2H4), ein farbloses Gas, das nicht nur für Kraftstoffe, sondern auch in der Produktion von Kunststoffen eine wichtige Rolle spielt. Obwohl sich die Spaltung einer N-N-Bindung in der Stickstofffixierung chemisch ganz fundamental von der Knüpfung einer C-C-Bindung in der CO-Reduktion unterscheidet, vermuteten Wissenschaftlerinnen und Wissenschaftler bisher, dass die Nitrogenase für beide Reaktionen die gleichen mechanistischen Grundprinzipien nutzt.
Zweites CO-Molekül am Aktivzentrum
Das Team um Rohde und Einsle hat in einer früheren Arbeit Nitrogenase mit dem Gas CO umgesetzt, was zur spezifischen Bindung eines einzigen Moleküls führte. In ihrer darauf aufbauenden, aktuellen Studie zeigen die Forschenden, dass sie die Kristalle dieses ersten Zustands unter Druck mit CO begast und dann einer röntgenkristallographischen Analyse unterzogen haben. Hierdurch konnte sie direkt beobachten, wie ein zweites CO-Molekül bindet. „Die so erhaltene Form der Nitrogenase mit zwei CO-Molekülen am Aktivzentrum stellt vermutlich einen blockierten Zustand dar“, erklärt Rohde, „doch liefert er unmittelbare Hinweise auf den Mechanismus des Enzyms.“ Dadurch kann das Team um Einsle nun einen ausführlichen Mechanismus der CO-Reduktion durch Nitrogenase skizzieren.