Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Elektrisches DipolmomentIn der Chemie ist das Dipolmoment ein Maß für die Stärke eines Dipolmoleküls. Weiteres empfehlenswertes FachwissenIn der Physik ist es (fast analog zur Chemie) ein Maß für die räumliche Ladungstrennung. Hat man in einem Körper, z. B.einem Molekül, an unterschiedlichen Orten eine elektrische Ladung unterschiedlichen Vorzeichens, d. h. wenn der Schwerpunkt der negativen Ladungen (Elektronen) und der Schwerpunkt der positiven Ladungen (Atomkerne) nicht zusammenfallen, besitzt dieser Körper ein elektrisches Dipolmoment. Der Körper ist dann ein Dipol.
Es sind auch andere Dipole (z. B. magnetische Dipole) möglich, die folglich auch andere Dipolmomente ausbilden. Befindet sich zu einer negativen Ladung -Q im Abstand Je höher die Ladung Q, desto höher auch das Dipolmoment. Auch wenn die Ladungen weiter auseinanderrücken (von der negativen zur positiven Ladung gerichteter Abstand l) wird das Dipolmoment größer. Trotz der Umstellung auf das SI-System wird weiterhin die cgs-Einheit Debye als Einheit des Dipolmoments verwendet, benannt nach dem holländischen Physiker Peter Debye. Der Grund dafür liegt darin, dass man bei der Verwendung der SI-Einheit Coulomb-Meter mit sehr kleinen Zahlen umgehen müsste: Für Moleküle liegt das Dipolmoment meist im Bereich von 0 bis 12 Debye. Das Dipolmoment kann man mit Hilfe der Debye-Gleichung durch Messung der Dielektrizitätskonstante bestimmen. Ferner geben Messungen des Stark-Effekts Auskunft über das Dipolmoment eines Stoffes. |
|||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Elektrisches_Dipolmoment aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





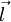 eine positive Ladung Q, und sind diese Ladungen untereinander starr verbunden, so besitzt diese Struktur ein Dipolmoment der Größe:
eine positive Ladung Q, und sind diese Ladungen untereinander starr verbunden, so besitzt diese Struktur ein Dipolmoment der Größe:
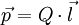
![[p]= 1\,\mathrm{Debye} = 3{,}336 \cdot 10^{-30}\,\mathrm{Coulomb} \cdot \mathrm{Meter}](images/math/9/6/b/96bee3775a3628763633052d06cbe085.png)


