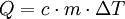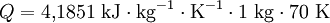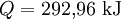Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Spezifische WärmekapazitätDie spezifische Wärmekapazität oder kurz spezifische Wärme eines Stoffes ist eine seiner physikalischen Eigenschaften und bezeichnet dessen auf die Masse bezogene Wärmekapazität. Sie gibt also an, welche Energie man einer bestimmten Masse eines Stoffes zuführen muss, um seine Temperatur um ein Kelvin zu erhöhen. Die abgeleitete SI-Einheit der spezifischen Wärmekapazität ist daher: Als Formelzeichen verwendet man in der Regel c (steht für engl. capacity = Kapazität). Die Messung der spezifischen Wärmekapazität erfolgt über die Kalorimetrie. Die Stoffdaten der spezifischen Wärmekapazität sind gesondert tabelliert. Weiteres empfehlenswertes Fachwissen
Mittlere spezifische WärmekapazitätDie mittlere spezifische Wärmekapazität wird für die Berechnung von Prozessen benötigt, bei denen die Temperaturabhängigkeit der Wärmekapazität von Bedeutung ist.
Die mittlere spezifische Wärmekapazität zwischen 0 °C und einer beliebigen Temperatur Falls die spezifische Wärmekapazität der vorhandenen Temperaturen t1 und t2 in den Tabellen nicht aufgeführt sind, müssen die Wärmekapazitäten durch lineare Interpolation gefunden werden. Es ist ausdrücklich darauf hinzuweisen, dass die Temperaturen in dieser Gleichung in Grad Celsius und nicht in Kelvin eingesetzt werden müssen, da es sich lediglich im Nenner der obigen Gleichung um eine Differenz handelt. Außerdem beziehen sich die Tabellenwerte ebenfalls auf Grad Celsius! Wärmekapazität von GasenInsbesondere bei Gasen hängt die Wärmekapazität von den äußeren Zwangsbedingungen ab. Man unterscheidet die Wärmekapazität bei konstantem Druck Cp und bei konstantem Volumen CV. Generell gilt Cp > CV Das kommt daher, dass bei isochoren Zustandsänderungen die zugeführte Wärmemenge komplett zur Erhöhung der Temperatur des Gases (also zur Erhöhung der kinetischen Energie der Gasteilchen) beiträgt. Bei isobaren Prozessen hingegen muss Volumenarbeit verrichtet werden, da sich das Gas beim Erwärmen ausdehnen muss, wenn der Druck konstant bleiben soll. D.h. bei konstantem Druck wird ein Teil der zugeführten Wärmeenergie in Form von Volumenarbeit "verbraucht". Deshalb muss bei isobaren Zustandsänderungen mehr Wärmeenergie zugeführt werden um ein Gas um ein Grad zu erwärmen als bei isochoren Zustandsänderungen. In erster Näherung gilt bei Gasen Cp = CV + Rs. Hierbei ist Rs die spezifische Gaskonstante, mit Rs = R/M, wobei R allgemeine Gaskonstante und M die Molmasse ist. Weiterhin gilt in guter Näherung CV = f · 1/2 · Rs, wobei f ≥ 3 die Anzahl der energetischen Freiheitsgrade eines Moleküls angibt. Diese umfassen drei Freiheitsgrade kinetische Energie, Null bis drei Freiheitsgrade für die Rotationsenergie und Null bis n Freiheitsgrade für die innere Schwingungsenergie. Bestimmung der WärmekapazitätEine häufig verwendete Methode zur Bestimmung der Wärmekapazität ist die Dynamische Differenzkalorimetrie (DSC). Wichtig für die Messung ist dabei, dass die zu untersuchende Probe in dem zu untersuchenden Temperaturbereich keine mit einer Wärmetönung einhergehenden Reaktion aufweist. Üblicherweise erfolgt zur exakten Berechnung eine Vergleichsmessung mit einem Saphir. GleichungenDie Gleichung, um Wärme, Masse, Temperaturänderung und spezifische Wärmekapazität in Zusammenhang zu bringen, ist: dabei ist Q die Wärme, die der Materie zugeführt oder entzogen wird, m ist die Masse der Substanz (in kg), c ist die spezifische Wärmekapazität (in kJ·kg-1·K-1) und ΔT ist die Temperaturänderung (in K).
Tabellen der spezifischen Wärmekapazität
Literatur
Siehe auch
Kategorien: Thermodynamik | Stoffeigenschaft |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Spezifische_Wärmekapazität aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


![[c]=\frac{\mathrm {kJ}}{\mathrm{kg} \cdot \mathrm{K}}=\frac{\mathrm {J}}{\mathrm{g} \cdot \mathrm{K}}](images/math/6/9/b/69b2b43b097ed615c4c3704bce6d3c9b.png)



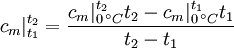 oder einfacher:
oder einfacher:
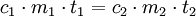 oder
oder 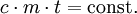 .
.
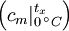 kann aus Tabellen abgelesen werden.
kann aus Tabellen abgelesen werden.