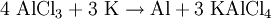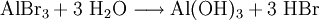Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Aluminium
Aluminium (Al) ist das chemische Element mit der Ordnungszahl 13. Die Bezeichnung leitet sich ab vom lateinischen Wort alumen für Alaun. Im Periodensystem der Elemente gehört Aluminium zur Borgruppe, die früher auch als Gruppe der Erdmetalle bezeichnet wurde. Aluminium ist das dritthäufigste Element und häufigste Metall in der Erdkruste. Dort tritt es wegen seiner Reaktionsfreudigkeit nur in chemisch gebundenem Zustand auf. Produkt-Highlight
GeschichtePlinius berichtet, dass einst im Palast des Kaisers Tiberius, der in den Jahren 14 bis 37 n. Chr. regierte, ein Metallarbeiter erschien und ein metallisches Geschenk anbot, das äußerlich wie Silber aussah, aber auffallend leicht war. Der Kaiser fragte den Arbeiter, wo dieses Metall zu finden wäre, und erhielt die Antwort, dass jener es aus einer tonhaltigen Erde hergestellt hätte. Tiberius fragte weiter, ob sonst noch jemand um das Vorhandensein und die Herstellung dieses Metalls wüsste, worauf der Arbeiter zu seinem Unheil erwiderte, dass außer ihm nur Jupiter das Geheimnis kenne. Der Kaiser aber war von Argwohn erfasst, dass das neue Metall den Wert des Goldes und des Silbers schädigen könnte und ließ daher die Werkstatt des Geschenkgebers zerstören und denselben enthaupten, so dass die Erfindung verloren ging. Der erste heute noch bekannte Aluminiumgegenstand ist die Gürtenschnalle des chinesischen Generals Chou-Chou (265-316) um 300. Als Sir Humphry Davy im Jahre 1808 das Aluminium entdeckte und beschrieb, erinnerte man sich wieder des Schicksals dieses unglücklichen Metallarbeiters und es verbreitete sich die Meinung, dass es sich bei diesem sagenhaften Metall um Aluminium gehandelt habe. Auch wenn ein wahrer Kern in dieser Erzählung stecken würde, so wäre es gänzlich ungeklärt, wie ein einzelner Arbeiter die technischen Schwierigkeiten hätte überwinden können, die bei der Aluminiumerzeugung zu überwinden sind. Erst 1825 gelang es dem Dänen Hans Christian Ørsted, Aluminium, das in der Natur nicht in gediegener Form vorkommt, synthetisch herzustellen, allerdings in sehr verunreinigter Form. Die Herstellung von reinem Aluminium in Pulverform gelang 1827 dem deutschen Chemiker Friedrich Wöhler. Zu jener Zeit war der Preis von Aluminium höher als der von Gold. Henri Sainte-Claire Deville verfeinerte den Wöhler-Prozess im Jahr 1846 und publizierte ihn 1859 in einem Buch. Dadurch fiel der Aluminiumpreis innerhalb von zehn Jahren um 90 Prozent. 1886 wurde unabhängig voneinander durch Charles Martin Hall und Paul Héroult das jetzt nach ihnen benannte Elektrolyseverfahren zur Herstellung von Aluminium entwickelt: der Hall-Héroult-Prozess. Nach diesem Prinzip erfolgt noch heute die großtechnische Aluminiumherstellung. Im Jahr 1889 wurde das Verfahren durch Carl Josef Bayer weiter verbessert. VorkommenAluminium ist mit einem Anteil von 7,57 Gewichtsprozent nach Sauerstoff und Silicium das dritthäufigste Element der Erdkruste und damit das häufigste Metall. Es tritt allerdings nicht gediegen auf, sondern nur in chemischen Verbindungen. Aluminium findet man in der Natur häufig in Alumosilikaten, wo es in der Kristallstruktur die Position von Silicium in Sauerstoff-Tetraedern einnimmt, als Bestandteil von z. B. Ton, Gneis und Granit. Da es aus den Alumosilikaten aufgrund der Bindungsverhältnisse praktisch nicht isoliert werden kann, ist eine wirtschaftliche Gewinnung nur aus Bauxit möglich. Bauxit enthält ca. 60 Prozent Aluminiumhydroxid (Al(OH)3 und AlO(OH)), ca. 30 Prozent Eisenoxid (Fe2O3), und Siliziumoxid (SiO2). In seltener Form ist Aluminiumoxid in Korund, bekannt als Rubin und Saphir, vorhanden. Die rote oder blaue Farbe der Steine entsteht durch Verunreinigungen. Bauxitvorkommen befinden sich in Südfrankreich (Les Baux), Guinea, Bosnien und Herzegowina, Ungarn, Russland, Indien, Jamaika, Australien, Brasilien und den USA. Gewinnung und DarstellungDie industrielle Erzeugung wurde durch den Pariser Universitätsprofessor Louis Jacques Thénard veranlasst. Nach dem Verfahren von Ørsted (1825) kann Aluminium aus Aluminiumchlorid und Kaliumamalgam hergestellt werden, wobei Kalium als Reduktionsmittel dient: Nach Wöhler wird metallisches Kalium zur Reduktion verwendet. Heute erfolgt die großtechnische Herstellung von Aluminium ausschließlich durch Schmelzflusselektrolyse (Kryolith-Tonerde-Verfahren) aus Aluminiumoxid (Al2O3), welches aus Aluminiumhydroxid durch Brennen in Drehrohröfen gewonnen wird. Durch das Bayer-Verfahren (Nasser Aufschluss mit Natronlauge) wird das im Erz Bauxit enthaltene Aluminiumoxid/-hydroxid-Gemisch zuvor von Fremdbestandteilen wie Eisen- und Siliziumoxid befreit. Der sogenannte Trockene Aufschluss (Deville-Verfahren) hat dagegen keine Bedeutung mehr. Beim Trockenen Aufschluss wird feinstgemahlenes Bauxit zunächst ungereinigt zusammen mit Soda und Koks in Drehrohröfen bei rund 1200 °C kalziniert, und das entstehende Natrium-Aluminat erst anschließend mit Natronlauge gelöst. Das Aluminiumoxid wird in einer Kryolithschmelze aufgelöst und elektrolysiert (Schmelzflusselektrolyse). Der Prozess ist aufgrund der hohen Bindungsenergie des Aluminiums recht energieaufwändig, etwa 13 - 15 kWh pro produziertem kg Aluminium. Zum Vergleich: Bei 13,5 kWh/kg verbraucht die Herstellung einer Tonne Aluminium so viel Energie wie ein durchschnittlicher Haushalt in 3,8 Jahren. (Basis: Haushalt verbraucht 3500 kWh im Jahr.) Bei der Elektrolyse entsteht an der den Boden des Gefäßes bildenden Kathode Aluminium und an der Anode Sauerstoff, der mit dem Graphit (Kohlenstoff) der Anode zu Kohlendioxid und Kohlenstoffmonoxid reagiert. Die Graphitblöcke, welche die Anode bilden, brennen wegen des im Prozess entstehenden Sauerstoffs langsam ab und werden von Zeit zu Zeit ersetzt. Die Graphit-Kathode (Gefäßboden) ist gegenüber dem Aluminium inert. Das sich am Boden sammelnde flüssige Aluminium wird mit einem Saugrohr abgesaugt. Umweltverbände kritisieren wegen des hohen Energieverbrauchs daher den Einsatz von Aluminium insbesondere zu Verpackungszwecken, da sich Aluminium nur in kompakter, möglichst wenig verunreinigter Form mit vergleichsweise geringem Aufwand recyceln lässt. Die Tonerde- bzw. Bauxit-Vorkommen sind dagegen sehr groß und häufig, weshalb man die Aluminiumherstellung gern in der Nähe preiswert zur Verfügung stehender Elektroenergie (z.B. bei Wasserkraftwerken) ansiedelt. Eigenschaften
Das reine Leichtmetall Aluminium hat aufgrund einer sich sehr schnell an der Luft bildenden dünnen Oxidschicht ein stumpfes, silbergraues Aussehen. Die undurchdringliche Oxidschicht macht reines Aluminium sehr korrosionsbeständig. Durch elektrische Oxidation (Eloxieren) oder auf chemischem Weg kann die schützende Oxidschicht verstärkt werden. Aluminium reagiert heftig mit Natriumhydroxid unter Bildung von Wasserstoff. Diese Reaktion wird in chemischen Rohrreinigungsmitteln ausgenutzt. Mit Brom reagiert Aluminium bei Zimmertemperatur unter Flammenerscheinung. Hierbei ist zu beachten, dass das entstehende Aluminiumbromid mit Wasser unter Bildung von Aluminiumhydroxid und Bromwasserstoffsäure reagiert. Mit Quecksilber bildet Aluminium ein Amalgam. Aluminium ist ein relativ weiches und zähes Metall, die Zugfestigkeit von purem Aluminium liegt bei 49 MPa, die von seinen Legierungen bei 300–700 MPa. Seine Steifigkeit liegt je nach Legierung bei etwa 70 000 MPa. Es ist dehnbar und kann durch Auswalzen zu dünner Folie verarbeitet werden. Sogenannte Aluminium-Knetlegierungen lassen sich auch bei niedrigen Temperaturen gut verformen, biegen, pressen und schmieden. Durch Kaltverformen entstandene Spannungen können durch Weichglühen (bis 250 °C) beseitigt werden. Auch Duraluminium wird dadurch vorübergehend verformbar. Legierungen mit 1-3 % Magnesium und/oder Silizium lassen sich gut gießen (Aluminium-Druckguss) und spanabhebend bearbeiten. Aluminium ist ein guter elektrischer Leiter (die Leitfähigkeit beträgt 60 Prozent von der des Kupfers). Aluminium bildet an Luft bei Raumtemperatur eine spontane Oxidschicht, die bei der elektrischen Kontaktierung und beim Schweißen hinderlich ist. Der Schmelzpunkt liegt bei 660,4 °C und der Siedepunkt bei 2467 °C. Die Dichte von 2,7 g/cm³ bei Aluminium zeigt den Typus als Leichtmetall deutlich. Aluminium leitet Strom je Gramm Gewicht besser als Kupfer, ist aber voluminöser als dieses, so dass Kupfer je Quadratzentimeter Leitungsquerschnitt Strom besser leitet als Aluminium. Weil Kupfer reaktionsträger und die Verarbeitung problemloser als bei Aluminium ist, wird meistens Kupfer verwendet und Aluminium nur, wenn es auf das Gewicht ankommt. VerwendungKonstruktionswerkstoffWegen seiner geringen Dichte wird Aluminium gern dort verwendet, wo Masse eines Transportmittels mitbewegt werden muss und zum Treibstoffverbrauch beiträgt, vor allem in der Luft- und Raumfahrt. Auch im Fahrzeugbau gewinnt es aus diesem Grund an Bedeutung; hier stand bisher der hohe Materialpreis, die schlechtere Schweißbarkeit sowie die problematische Dauerbruchfestigkeit und die Verformungseigenschaften bei Unfällen (geringes Energieaufnahmevermögen in der sogenannten Knautschzone) im Wege. In Legierungen mit Magnesium, Silizium und anderen Metallen werden Festigkeiten erreicht, die denen von Stahl nur wenig nachstehen. Daher ist die Verwendung von Aluminium zur Gewichtsreduzierung überall dort angebracht, wo Materialkosten eine untergeordnete Rolle spielen. Insbesondere im Flugzeugbau und in der Weltraumtechnik ist Aluminium und Duraluminium weit verbreitet. Aluminium lässt sich durch Strangpressen in komplizierte Profile formen, hierin liegt ein großer Vorteil bei der Fertigung von Hohlprofilen (Automatisierungstechnik, Messebau), Kühlkörperprofilen oder in der Antennentechnik. Mit Aluminium werden Heizelemente von Bügeleisen und Kaffeemaschinen umpresst. Aluminium-Gussteile können durch Druckguss in komplizierten Formen gefertigt werden, die spanende Nachbearbeitung ist gut möglich. Bevor es gelang, Zinkblech durch Titanzusatz korrosionsfest zu machen, wurde Aluminiumblech für Fassaden- und Dachelemente sowie Dachrinnen eingesetzt. Elektrotechnik Aluminium wird insbesondere dann als Leitermaterial für elektrischen Strom im Stromnetz verwendet, wenn es sich um starre und dicke Leitungen handelt (Stromschienen, Erdkabel). Hervorzuheben ist das geringe Absinken der spezifischen elektrischen Leitfähigkeit von Aluminium bei Zusatz von Legierungsbestandteilen, wohingegen Kupfer bei Verunreinigungen eine stark absinkende Leitfähigkeit zeigt. Aluminium wird auch in Überlandleitungen (Freileitungen) als Leitungsmaterial verwendet – die geringe Dichte ist hier ausschlaggebend. Kupferleitungen mit der gleichen Leitfähigkeit hätten zwar einen geringeren Querschnitt, jedoch etwa die doppelte Masse. Aus dem gleichen Grund werden im Airbus A380 ebenfalls Aluminiumkabel verwendet. Für Oberleitungen ist es dagegen aufgrund seiner schlechten Kontakt- und Gleiteigenschaften ungeeignet. Aluminium wird zur Fertigung von Kurzschlussläufern von Asynchronmotoren verwendet, indem deren Blechpakete umgossen werden. ElektronikDie Elektronikindustrie setzt Aluminium aufgrund der guten Verarbeitbarkeit und der guten elektrischen Leitfähigkeit und Wärmeleitfähigkeit ein. Bonddrähte (Verbindungsdrähte zwischen Chip und Gehäuseanschluss) bestehen insbesondere bei Leistungshalbleitern aus Aluminium. Die Leiterbahnen integrierter Schaltkreise und von Leistungshalbleitern bestehen oft ebenfalls aus Aluminium. Wegen seiner hohen Wärmeleitfähigkeit wird Aluminium als Werkstoff für Wärmeübertrager (Kühler), stranggepresste Kühlprofile und wärmeableitende Grundplatten verwendet (bei höherwertigen Kühlern wird allerdings wegen der höheren Wärmeleitfähigkeit Kupfer verwendet). Aluminium-Elektrolytkondensatoren verwenden Aluminium als Elektrodenmaterial und Gehäusewerkstoff. Aluminium wird zur Herstellung von Antennen und Hohlleitern verwendet. Verpackung und BehälterIn der Verpackungsindustrie wird Aluminium zu Getränke- und Konservendosen sowie Aluminiumfolie und weiteren Einwegartikeln verarbeitet. Aluminium wird für eine Vielzahl von Behältern und Gehäusen verarbeitet, da es sich gut durch Umformen bearbeiten lässt. Gegenstände aus Aluminium werden häufig durch eine Eloxalschicht geschützt. Optik und LichttechnikAluminium wird aufgrund seines hohen Reflexionsgrades als Spiegel-Beschichtung von Oberflächenspiegeln, u. a. in Scannern, Kraftfahrzeug-Scheinwerfern und Spiegelreflexkameras eingesetzt. Es reflektiert im Gegensatz zu Silber auch Ultraviolettstrahlung. Aluminium-Spiegelschichten werden meist durch eine Schutzschicht vor Korrosion und Kratzern geschützt. Weitere AnwendungenAluminium ist Bestandteil einer Lebensmittelfarbe (E173) und findet bei Überzügen von Zuckerwaren und zur Dekoration von Kuchen und feinen Backwaren Verwendung. Farbig eloxiert ist es Bestandteil vieler Dekorationsmaterialien wie Flitter, Geschenkbänder und Lametta. In Pulverform (Partikelgröße < 500 µm) ist Aluminium vor allem dann, wenn es nicht phlegmatisiert ist, aufgrund seiner großen Oberfläche sehr reaktiv. Aluminium reagiert dann mit Wasser unter Abgabe von Wasserstoff zu Aluminiumoxid. VerarbeitungsverfahrenAluminium wird meist legiert verwendet. Es gibt eine Vielzahl von Legierungen, die entweder gute Verformbarkeit oder gute Gießbarkeit und spanende Bearbeitbarkeit zeigen. Aluminium wird durch Gießen bzw. Urformen in Aluminiumgießereien nach folgenden Gießverfahren verarbeitet:
Hierbei werden Verfahren unterschieden, die der Herstellung (fast) fertiger Bauteile dienen (z. B. Sandguss, Druckguss, Feinguss), und solchen, die Rohmaterial für die Weiterverarbeitung zu Halbzeug wie Blechen und Strangpressprofilen liefern (z. B. Strangguss). Sprühkompaktieren und Bandguss nehmen eine Sonderstellung ein. Die Herstellung von Halbzeug oder Bauteilen geschieht aus Vormaterial wie z. B. Walzbarren, Blech oder Ronden durch Umformen:
Die spanende Bearbeitung birgt die Gefahr einer Aufbauschneide und erfordert spezielle Kühlschmiermittel. Aluminium kann daher auch nur mit speziellen Schleifscheiben geschliffen werden. Aluminium in Natur und OrganismenAluminium ist eines der wenigen reichlich vorhandenen Elemente, die anscheinend von Lebewesen nicht genutzt werden. Der Grund könnte darin liegen, dass Aluminium ursprünglich, als sich das Leben im Meer entwickelte, im Meerwasser in gelöster Form fast überhaupt nicht vorhanden war und somit von dem sich entwickelnden Leben nicht genutzt werden konnte. Das Leben hat gelernt, ohne Aluminium auszukommen. Erst im Laufe der Jahrmilliarden wurde Aluminium allmählich durch Flüsse im Meer angereichert, obwohl auch heute noch die Konzentration im Meer sehr gering ist. Für diese These spricht auch, dass die Aluminiumkonzentration im Flusswasser wesentlich höher liegt als im Meerwasser. Aluminium wird durch zunehmende Säurebelastung der Böden von den Pflanzen vermehrt aufgenommen. Wir bekommen mit der Nahrung täglich im Durchschnitt 25 mg Aluminium. Wenn Speisen nun noch im Aluminiumgeschirr zubereitet (saure Lebensmittel lösen Aluminium!) und in Alufolie aufbewahrt werden, kann sich die Aufnahme um das zwei- bis dreifache erhöhen. Aluminium ist Bestandteil einer Lebensmittelfarbe (E173) und findet bei Überzügen von Zuckerwaren und zur Dekoration von Kuchen und feinen Backwaren Verwendung. Aluminium ist in Backpulver, Schmelzkäse, Scheibletten sowie sauer eingelegten Gemüsekonserven, als Antiklumpmittel in Kaffeeweißern, Salz und Gewürzen enthalten. Bei der Untersuchung von Laugengebäck (Brezeln, Stangen, Brötchen) aus Bäckereien wurde Aluminium nachgewiesen, das in das Lebensmittel gelangt, wenn bei der Herstellung von Laugengebäck Aluminiumbleche verwendet werden.[2] Aluminiumverbindungen finden sich außerdem in Körperpflegemitteln (mineralischer Sonnenschutz, Deo, Zahnpasta), in Medikamenten gegen Magenübersäuerung (Antacida), Durchfallmitteln (Kaolin, Attapulgite, Bolus) und in manchen Lipidsenkern (Aluminiumclofibrat), sowie in Industrieemissionen aus der Herstellung von Aluminium, der Papier-, Glas-, Porzellan- und Textilindustrie. Aluminiumverbindungen können an Anämie beteiligt sein, weil es dieselben Speichereiweiße wie Eisen besetzt. Es kann den Knochenstoffwechsel beeinträchtigen, Arthritis begünstigen, Beschwerden des Nervensystems wie z. B. Gedächtnis- und Sprachstörungen , Antriebslosigkeit und Aggressivität fördern und führt auf jeden Fall mit der Zeit zu Leber- und Nierenschädigungen (dagegen hilft auch ein Leber- oder Nierenprogramm). Aluminium stört den Stoffwechsel von Calcium, Chrom, Eisen, Fluorid, Kupfer, Magnesium, Phosphat, Silicium, Zink sowie der Vitamine B6 und D. Laut neuesten Untersuchungen des Bundesinstituts für Risikobewertung (BfR) besteht kein Zusammenhang zwischen der Aluminiumaufnahme aus Lebensmittelbedarfsgegenständen und Alzheimer.[3] Einige Prozent der Bevölkerung reagieren auf Aluminium stark allergisch – sie erleiden Ausschläge in jeder möglichen Form durch Verwenden von Antitranspirationsprodukten, Verdauungsstörungen und Unfähigkeit, Nährstoffe aus der Nahrung aufzunehmen, die in Aluminiumtöpfen gekocht wurde, oder Erbrechen und anderen Vergiftungserscheinungen durch Einnehmen aluminiumhaltiger Medikamente. Aspekte des Umweltschutzes
Die Herstellung von Aluminium ist sehr energieaufwändig. Allein für die Elektrolyse, die zum Gewinn einer Tonne Aluminiums nötig ist, werden 14.000 kWh elektrische Energie benötigt. Durch den Abbau des Erzes Bauxit werden große Flächen in Anspruch genommen. Als Abfall entsteht dabei der umweltschädliche Rotschlamm. Pro gewonnener Tonne Aluminium fallen ca 1,5 Tonnen davon an. Positiv ist hingegen die hohe gute Recyclierbarkeit von Aluminium hervorzuheben, wobei die Reststoffe streng getrennt erfasst und gereinigt werden müssen. Durch Leichtbau mit Aluminiumwerkstoffen (beispielsweise Aluminiumschaum, Strangpressprofile) wird Masse von beweglichen Teilen und Fahrzeugen gespart, was zur Einsparungen beim Treibstoffverbrauch führen kann. Aluminium ist korrosionsfester als Eisen und erfordert daher weniger umweltbelastende Korrosionsschutzmaßnahmen. NachweisAluminiumsalze weist man durch Glühen mit verdünnter Kobaltnitratlösung auf der Magnesia-Rinne nach. Dabei entsteht das Pigment Thénards Blau (auch Kobaltblau oder Cobaltblau, Dumonts Blau, Coelestinblau, Leithners Blau, Cobaltaluminat). Es ist ein Cobaltaluminiumspinell mit der Formel CoAl2O4. Diese Nachweisreaktion wurde 1795 von Leithner durch Glühen von Aluminiumsulfat und Cobaltnitrat (Co(NO3)2) entdeckt. Nachweis mittels KryolithprobeDie Probelösung wird alkalisch gemacht, um Aluminium als Aluminiumhydroxid Al(OH)3 zu fällen. Der Niederschlag wird abfiltriert und mit einigen Tropfen Phenolphthalein versetzt, dann gewaschen, bis keine Rotfärbung durch Phenolphthalein mehr vorhanden ist. Anschließend festes Natriumfluorid (NaF) auf den Niederschlag streuen: Es bildet sich eine Rotfärbung durch Phenolphthalein, verursacht von freigesetzten Hydroxidionen. Nachweis als fluoreszierender MorinfarblackDie Probelösung wird mit Kaliumhydroxid (KOH) erhitzt und anschließend mit konzentrierter Essigsäure (Eisessig, CH3COOH) angesäuert. Nach Zugabe von Morin-Lösung ist unter UV-Strahlung (λ = 366 nm) eine grüne Fluoreszenz beobachtbar. AluminiumlegierungenHauptartikel: Aluminiumlegierung Aluminium kann im schmelzflüssigen Zustand mit Kupfer, Magnesium, Mangan, Silizium, Eisen, Titan, Beryllium, Lithium, Chrom, Zink, Zirkon und Molybdän legiert werden, um bestimmte Eigenschaften zu fördern oder andere, ungewünschte Eigenschaften zu unterdrücken. Bei den meisten Legierungen ist jedoch die Bildung der schützenden Oxidschicht (Passivierung) stark gestört, wodurch die daraus gefertigten Bauteile teils hochgradig korrosionsgefährdet sind. Nahezu alle hochfesten Aluminiumlegierungen sind von dem Problem betroffen. Es gibt Aluminiumknetlegierungen (AW, engl. wrought), zum Beispiel AlMgMn, und Aluminiumgusslegierungen (AC, engl. cast). Aluminiumgusslegierungen werden z. B. für Leichtmetallfelgen verwendet. Im Allgemeinen werden Aluminiumlegierungen nach dem System der AA (Aluminum Association) bezeichnet.
Verbindungen
Unter besonderen Bedingungen tritt Aluminium auch einwertig auf. Diese Verbindungen benutzt man zur Gewinnung von hochreinem Aluminium (Subhalogeniddestillation). Siehe auch
Quellennachweise
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Aluminium aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||