Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Affinität (Biochemie)Die Affinität ist in der Biochemie ein Maß für die Bindungsstärke zwischen den Bindungspartnern bei Protein-Ligand-Wechselwirkungen: Je höher die Affinität, desto größer die Assoziationskonstante, Ka (auch "Bindungskonstante" genannt). Produkt-HighlightGängigerweise wird heute allerdings das reziproke Maß, die Dissoziationskonstante, Kd gebraucht: je höher die Affinität eines Proteins zu seinem Liganden, desto niedriger die Dissoziationskonstante des Komplexes. Am Beispiel der Bildung/des Zerfalls eines Enzym-Substratkomplexes, [ES]
werden hier die Definitionen gemäß Massenwirkungsgesetz bzw. kinetischen Konstanten (Geschwindigkeitskonstanten k) aufgeführt:
In der Enzymkinetik wird gelegentlich Km, die Michaeliskonstante, als Maß für die Affinität eines Enzyms zu seinem Substrat angegeben. Dies hat in der Praxis eine gewisse Berechtigung, theoretisch sind die Dissoziationskonstante des ES-Komplexes Kd und die Michaeliskonstante jedoch streng zu unterscheiden. Die Michaeliskonstante hängt nach Briggs und Haldane auch von der Wechselzahl k2 ab und berechnet sich wie folgt:
Ein Rückschluss von Km auf Kd ist nur dann möglich wenn Siehe auch |
||||||||
| Dieser Artikel basiert auf dem Artikel Affinität_(Biochemie) aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





![K_a = {[ES] \over [E] * [S] }](images/math/b/a/9/ba94d21d09683594bff7369132929117.png)
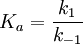
![K_d = {[E] * [S] \over [ES]}](images/math/4/3/b/43b5250ff0c4d0cd6c9ee979a4c12691.png)
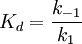
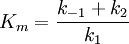
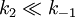 . Diese Annahme ist nicht in jedem Fall angebracht, wurde aber ursprünglich von
. Diese Annahme ist nicht in jedem Fall angebracht, wurde aber ursprünglich von 

