Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Hammettsche AciditätsfunktionZur Quantifizierung der Säurestärke von Supersäuren führten Louis P. Hammett und Alden J. Deyrup 1932 die so genannte Hammett-Funktion H0 ein[1], da die pH-Skala nach Sørensen nur für verdünnte Lösungen geeignet und durch die Autoprotolysekonstante für Wasser beschränkt ist. Produkt-HighlightDer Protonierungsgrad Aus dem Massenwirkungsgesetz für das Gleichgewicht
Nimmt man an, dass Nach Ronald J. Gillespie [6] gilt für Supersäuren: Je nach Zusammensetzung sind Werte von H0 = - 15,1 (HSO3F, aHF (a steht für anhydrous = wasserfrei.) [7] bis hin zu Siehe auchQuellen
Kategorien: Säure-Base-Reaktion | Chemische Größe | Anorganische Chemie | Physikalische Chemie |
| Dieser Artikel basiert auf dem Artikel Hammettsche_Aciditätsfunktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





![\frac{\left[ BH^{+} \right] }{\left[ B \right]}](images/math/5/1/a/51a4c6014250b592f365edc11add1adc.png) einer schwachen organischen Base
einer schwachen organischen Base 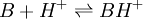 lässt sich herleiten:
lässt sich herleiten:
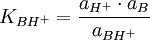 mit der
mit der 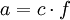
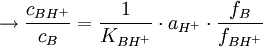
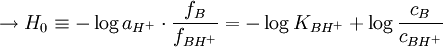
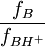 gleich ist für verschiedene Basen in einer bestimmten Lösung, so lässt sich, wenn man
gleich ist für verschiedene Basen in einer bestimmten Lösung, so lässt sich, wenn man ![H_{0} = pK_{BH^{+}} - \log \frac{\left[ BH^{+} \right] }{\left[ B \right]}](images/math/c/a/2/ca2b9c4f29057b6f1bcf43d10bbb8148.png) die Säurestärke bestimmen. Die experimentelle Bestimmung von
die Säurestärke bestimmen. Die experimentelle Bestimmung von 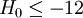 .
.
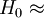 - 27 (HSO3F + SbF5 (
- 27 (HSO3F + SbF5 (

