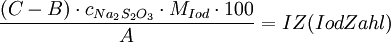Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
IodzahlDie Iodzahl (IZ) ist neben der Verseifungszahl eine Eigenschaft, die zur Charakterisierung von Fetten verwendet wird. Sie nimmt mit zunehmendem Anteil an ungesättigten Fettsäuren zu. Die Iodzahl ist ein Maß für den Gehalt eines Fettes an ungesättigten Verbindungen (Doppelbindungen). Sie ist die Menge in Gramm Iod, die an 100 Gramm Fett addiert werden kann. Demnach kann man mit ihr den ungesättigten Charakter des Fettes, sowie den Aggregatzustand, bestimmen. Zuerst gibt man zu einer bestimmten Menge in g eines Fettes, welche als Wert A vermerkt wird, im Überschuss Iodbromid hinzu. Die Iod- und Bromteilchen setzen sich an den Doppelbindungen an, allerdings nicht komplett. Den Rest IBr, der durch den Überschuss übrig geblieben ist, versetzt man mit Kaliumiodid bis sich ein Niederschlag bildet. Dadurch wird das IBr zu I2 reduziert. Die durch das gelöste Iod gelbe Lösung wird, nach der Zugabe von Stärkelösung (als Indikator) mit 0,1 molarer Natriumthiosulfatlösung bis zur Farblosigkeit titriert. Das verbrauchte Natriumthiosulfat in ml stellt dann den Wert B dar. Als letztes macht man dann noch eine Blindprobe, bei der man die Hälfte des Volumens des vorher verwendeten Iodbromids, also statt 20 ml 10ml, mit Kaliumiodid versetzt und mit Natriumthiosulfat titriert. Der jetzige Verbrauch wird verdoppelt als Wert C dargestellt. Diese Reaktionen müssen in saurem Milieu stattfinden. Die Iodzahl wird dann mit der folgenden Formel berechnet:
Beispiele für typische Iodzahlen:
Produkt-Highlight
Methoden zur Bestimmung der Iodzahl
Iodzahl nach WijsReagenzien
Herstellung der Lösungen
100 g Natriumthiosulfat-5-hydrat werden auf 4 Liter mit dest. Wasser aufgefüllt.
150 g Kaliumiodid werden auf 1 Liter mit dest. Wasser aufgefüllt.
5 g Stärke werden mit ca. 200 ml dest. Wasser gekocht, bis sich die Stärke gelöst hat. Anschließend wird auf 500 ml mit dest. Wasser aufgefüllt. Faktoreinstellung0,1-0,15 g Kaliumdichromat werden auf 0,001 g genau in einen Erlenmeyerkolben eingewogen und mit 20 ml Kaliumiodidlösung versetzt. Nach der Zugabe von ca. 5 ml konz. Salzsäure wird mit dest. Wasser auf etwa 50 ml aufgefüllt. Unmittelbar darauf titriert man unter Zusatz von Stärke, als Indikator, die einzustellende Natriumthiosulfat-Lösung bis zur Grünfärbung. Der Faktor berechnet sich wie folgt: T = (E x 1000)/(4,903 x V) Faktor für die Iodzahl: T x 1,269 T= Titer V = Verbrauch an Natriumthiosulfat-Lösung E = Einwaage Kaliumdichromat in g Es sind drei Bestimmungen, die nicht weiter als 1 % auseinanderliegen, zu einem Mittelwert zusammenzufassen. DurchführungDie Einwaage richtet sich nach der zu erwartenden Iodzahl: Einwaage in Gramm = (10 x Faktor)/erwartete Iodzahl
Die Einwaage wird auf 0,1 mg genau in einem 250 ml Erlenmeyerkolben mit Schliff NS 29 eingewogen und in etwa 20 ml Chloroform gelöst. Nach Zugabe von exakt 20 ml Iodlösung nach Wijs und gutem Durchschütteln wird der Kolben mit einem Stopfen verschlossen und eine Stunde im Dunkeln belassen. Anschließend werden ca. 10 ml Kaliumiodidlösung zugegeben und mit 0,1 n Natriumthiosulfat-Lösung unter Zusatz von Stärkelösung titriert. Daneben wird in gleicher Weise ein Blindversuch angesetzt. BerechnungDie Iodzahl errechnet sich nach folgender Formel: IZ = (F x(A-B))/E
Kategorien: Chemische Größe | Analytische Chemie |
|||||||||||||||
| Dieser Artikel basiert auf dem Artikel Iodzahl aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |