Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Elektroden zweiter ArtElektroden zweiter Art sind Elektroden, deren Potential nur indirekt von der Konzentration der sie umgebenden Elektrolytlösung abhängt. Produkt-HighlightPrinzip (am Beispiel der Kalomel-Elektrode (GKE) / engl. Saturated Calomel Electrode (SCE))Die Konzentrationsunabhängigkeit des Potentials wird durch den besonderen Aufbau der Elektrode erreicht. Genauer gesagt wird durch die besondere Zusammensetzung der Elektrolytlösung das Potential konstant gehalten. Die Elektrolytlösung besteht:
Das Potential der Elektrode wird durch die Nernst-Gleichung beschrieben: (bei 25 °C bzw. 298,15 K)
Man sieht, dass das Potential E von der Konzentration des Kations des schwerlöslichen Salzes, nämlich AnwendungElektroden zweiter Art werden häufig in der Potentiometrie eingesetzt. Siehe auch |
| Dieser Artikel basiert auf dem Artikel Elektroden_zweiter_Art aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |





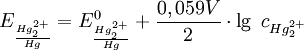
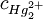 abhängt. Diese Konzentration ist wiederum über das Löslichkeitsprodukt des Kalomels mit der Konzentration des Anions gekoppelt. Wird die Konzentration des Anions konstant gehalten, bleibt folglich auch das Potential konstant. Diese Anionenkonzentration lässt sich nahezu konstant halten, indem deren Konzentration sehr groß gewählt wird (bei
abhängt. Diese Konzentration ist wiederum über das Löslichkeitsprodukt des Kalomels mit der Konzentration des Anions gekoppelt. Wird die Konzentration des Anions konstant gehalten, bleibt folglich auch das Potential konstant. Diese Anionenkonzentration lässt sich nahezu konstant halten, indem deren Konzentration sehr groß gewählt wird (bei 

