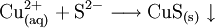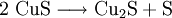Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Kupfer(II)-sulfid
Kupfer(II)-sulfid ist eine chemische Verbindung des Kupfers und Schwefels. Es ist ein schwarzer, spröder Feststoff mit der Verhältnisformel CuS. Trotz dieser Verhältnisformel liegen in der Verbindung nicht nur Cu2+-Ionen vor, sondern sie besteht eus einer Mischung von Cu+- und Cu2+-Ionen. Das genaue Verhältnis ist Cu2ICuII(S2)S[2]. Produkt-Highlight
VorkommenIn der Natur kommt Kupfer(II)-sulfid als das Mineral Covellin vor. Gewinnung und DarstellungKupfer(II)-sulfid wird (im Labor) durch Fällung aus wässriger Lösung dargestellt, beispielsweise durch Einleiten von Schwefelwasserstoff. Eigenschaften
Physikalische EigenschaftenKupfer(II)-sulfid ist ein schwarzer, wasserunlöslicher Feststoff, der in der Natur als sulfidisches Kupfererz vorkommt. In feuchter Luft wird das Erz Kupfer(II)-sulfid zu Kupfersulfat oxidiert. In trockener Luft bei Raumtemperatur ist die Verbindung stabil. Wird Kupfer(II)-sulfid unter Luftausschluss erhitzt, zerfällt es zu Kupfer(I)-sulfid und Schwefel: Das Rösten des Erzes an Luft führt hingegen zu Kupfer(II)-oxid und Schwefeldioxid. Chemische EigenschaftenKupfer(II)-sulfid ist löslich nur in konzentrierten, oxidierenden Säuren. Beispielsweise reagieren 3 mol CuS mit 8 mol konz. Salpetersäure zu Kupfersulfat (3 mol), Stickstoffmonoxid (8 mol) und Wasser (Redoxreaktion). In verdünnten Säuren ist es unlöslich. Im Kationentrenngang wird es daher schon bei pH 4–5 in der Schwefelwasserstoffgruppe ausgefällt, in Salpetersäure gelöst und mit Ammoniakwasser als Kupfertetramminkomplex nachgewiesen (Nachweise für Kationen, Nachweisreaktion). VerwendungKupfer(II)-sulfid wird für fäulnishemmende Anstriche verwendet. In den 1970er und 1980er Jahren wurde Kupfer(II)-sulfid als Kathodenmaterial in Lithium-Batterien für Herzschrittmacher eingesetzt. Quellen
Kategorien: Kupferverbindung | Sulfid |
|||||||||||||||||||||||||||||||||||||||||||||||
| Dieser Artikel basiert auf dem Artikel Kupfer(II)-sulfid aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. | |||||||||||||||||||||||||||||||||||||||||||||||