Um alle Funktionen dieser Seite zu nutzen, aktivieren Sie bitte die Cookies in Ihrem Browser.
my.chemie.de
Mit einem my.chemie.de-Account haben Sie immer alles im Überblick - und können sich Ihre eigene Website und Ihren individuellen Newsletter konfigurieren.
- Meine Merkliste
- Meine gespeicherte Suche
- Meine gespeicherten Themen
- Meine Newsletter
Redoxreaktion
Eine Redoxreaktion (gesprochen: redóx)(eigentlich: Reduktions-Oxidations-Reaktion) ist eine chemische Reaktion, bei der ein Reaktionspartner Elektronen auf den anderen überträgt. Bei einer solchen Elektronenübertragungs-Reaktion finden also eine Elektronenabgabe (Oxidation) durch einen Stoff sowie eine Elektronenaufnahme statt. Eine Oxidation geschieht fast immer unter Abgabe von Licht- und/oder Wärmeenergie (exotherm). Wenn Oxidation und Reduktion zusätzlich räumlich getrennt voneinander ablaufen, so wird ein solches System Galvanisches Element genannt – der Elektronenfluss kann hier zur Energiegewinnung genutzt werden (Beispiel: Batterie, Akkumulator). Von außen erzwungene Redoxreaktionen werden Elektrolyse genannt. Bei jeder Redoxreaktion reagiert ein Stoff A, der Elektronen abgibt (Reduktionsmittel, Donator genannt) mit mindestens einem Stoff B, der diese Elektronen aufnimmt (Oxidationsmittel, Akzeptor):
Redoxreaktionen sind von grundlegender Bedeutung in der Chemie: Jeder Stoffwechsel- und Verbrennungsvorgang, viele technische Produktionsprozesse und viele Nachweisreaktionen basieren auf solchen Elektronenübertragungs-Reaktionen. Produkt-Highlight
Oxidation und OxidationsmittelDie Oxidation (Elektronenabgabe)Der Begriff Oxidation wurde in der Geschichte der Chemie unterschiedlich definiert:
Die Oxidation ist nicht zwangsläufig mit einer vollständigen Abgabe von Elektronen und damit der Ionisation der beteiligten Stoffe verbunden – insbesonders in der Organischen Chemie und Biochemie. Vor allem hier, in der Biologie und Biochemie, definiert man Oxidation NICHT als „Abgabe von Wasserstoff“. Bei vielen biochemischen Vorgängen in der Zelle, z. B. der Glycolyse, werden organischen Verbindungen Wasserstoffatome durch bestimmte Coenzyme (NAD, NADP, FAD) „entrissen“. Das OxidationsmittelSauerstoff als OxidationsmittelEin Oxidationsmittel ist ein Stoff, der den Reaktionspartner oxidiert: Er entreißt ihm Elektronen. Als Oxidation im ursprünglichen Sinn bezeichnete man zunächst nicht die Elektronenabgabe, sondern die chemische Reaktion eines Stoffes mit Sauerstoff. Auch heute noch assoziiert man mit diesem Begriff vielfach nur die Umsetzung mit Sauerstoff oder die Bildung von Oxiden: Sauerstoff ist hier das Oxidationsmittel. Ein von reinem Sauerstoff durchströmtes Kupferrohr kann so zum Beispiel mit einem Schweißbrenner entzündet werden. Die so gestartete Redoxreaktion liefert eine solch intensive Verbrennungswärme, dass sich mit dieser Sauerstofflanze mühelos ein dicker Stein- oder Felsbrocken aufschmelzen und durchdringen lässt (Abbildung). Reagiert also ein Metallatom mit einem Sauerstoff-Atom, so kann man die Oxidation des Metalles (hier: Kupfer) und somit die Metalloxidbildung anhand folgender Reaktionsgleichungen nachvollziehen:
Sauerstoff hat in diesem Fall das Bestreben, durch Aufnahme von zwei Elektronen eine stabile Valenzelektronenschale mit insgesamt acht Elektronen aufzubauen (Oktettregel). Das Metall wiederum kann durch Abgabe der Elektronen teilbesetzte Schalen auflösen und so die nächst niedrigere stabile Elektronenkonfiguration erreichen. Sauerstoff reagiert als Oxidationsmittel also immer unter Aufnahme von 2 Elektronen pro Atom:
Ein 2:1-Wasserstoff-Sauerstoff-Gasgemisch reagiert bei Zündung explosiv und wird daher Knallgas genannt. Dass die Redoxreaktion auch durch einen Platindraht als Katalysator in Gang gesetzt werden kann entdeckte Johann W. Döbereiner (Bereits 1816 gelang ihm mit Hilfe von Platinmoor die Oxidation von Alkohol zu Essigsäure. Einige Jahre später gelang ihm die Entzündung eines Knallgasgemisches unter dem Einfluss von Platinschwamm. Diese Entdeckung führte zur Erfindung des ersten Feuerzeuges (des Döbereinerschen Platinfeuerzeugs).
Weitere OxidationsmittelNeben Sauerstoff können auch andere nichtmetallische Elemente sowie viele chemische Verbindungen als Oxidationsmittel reagieren und Elektronen aufnehmen. Der Begriff der Oxidation wurde später auf Reaktionen erweitert, die nach dem gleichen chemischen Prinzip ablaufen, auch wenn kein Sauerstoff daran beteiligt ist. Neben Sauerstoff starke Oxidationsmittel sind daher auch:
Halogene sind wie Sauerstoff so kräftige Oxidationsmittel, dass sie Metalle angreifen können (Korrosion). Zum Beispiel gibt bei der Entzündung des Leichtmetalles Natrium im Giftgas Chlor das Natriumatom ein Elektron an das Chloratom ab, Natrium wird also durch Chlor zu Natriumchlorid oxidiert. Im Gegenzug wird das Oxidationsmittel Chlor dabei reduziert:
Atome mit hoher Oxidationszahl sind ebenso wie die Halogene besonders gute Oxidationsmittel. Ein solches Beispiel ist Kaliumpermanganat, denn Mangan (Mn) hat hier die Oxidationszahl +VII. "Mühelos" oxidiert es daher Sulfit- zu Sulfationen, Eisen-II-ionen zu Eisen-III-ionen und Salzsäure zu Chlorgas. Die OxidationszahlDie Oxidationszahl gibt an, wie viele Elektronen ein neutrales Atom innerhalb einer Verbindung formal aufgenommen (negative Werte) beziehungsweise abgegeben (positive Werte) hat. Die Oxidationszahl eines Atoms in einer chemischen Verbindung ist formal also ein Maß zur Angabe der Verhältnisse der Elektronendichte um dieses Atom. Eine positive Oxidationszahl zeigt an, dass die Elektronendichte gegenüber seinem Normalzustand erniedrigt ist, eine negative zeigt an, dass die Elektronendichte um das Atom erhöht ist. Die Oxidationszahlen dienen bei Redoxreaktionen dazu, die Vorgänge besser zu erkennen: Die Übertragung der Elektronen von einem Atom auf ein anderes zeigt sich daran, dass sich die Oxidationszahl des einen (das Elektronen abgibt) erhöht, die des anderen (das Elektronen aufnimmt) erniedrigt. Oft wird erst durch die Bestimmung der Oxidationszahlen einzelner Atome klar, ob hier eine Oxidation (Elektronenabgabe) oder eine Reduktion (Elektronenaufnahme durch das Oxidationsmittel) abläuft. Früher wurden die Oxidationszahlen in Verbindungen in römischen Ziffern über die Atomsymbole geschrieben (Bsp. O-II). Heute ist das nach den Nomenklaturregeln der IUPAC nicht mehr zulässig; daher werden sie in arabischen Ziffern notiert, wobei im Gegensatz zur Bezeichnung der Ionenladung das Vorzeichen der Zahl vor der Ziffer steht. Bestimmung der OxidationszahlDie Oxidationszahl lässt sich leicht mit Hilfe von folgenden Regeln herleiten:
In der Praxis hat es sich als hilfreich erwiesen, für die Bestimmung der Oxidationszahlen einige Hilfsregeln zu formulieren:
Bei einem Molekül wird/werden das/die bindende(n) Elektronenpaar(e) also dem Atom zugesprochen, dessen Elektronegativität höher ist. Zahlen gleichartiger Atomverbindungen werden untereinander gleich aufgeteilt. Ionen haben als Summe ihrer Oxidationszahlen ihre Ladungszahl, Moleküle die Summe 0. Bedeutend sind die Oxidationszahlen jener Atome, die Bestandteil einer funktionellen Gruppe sind. Reduktion und ReduktionsmittelDie Reduktion (Elektronenaufnahme)Das Wort Reduktion ist aus dem latein. reductio (= Zurückführung) abgeleitet und bedeutet in der gehobenen Alltagssprache eine Verringerung des Ausmaßes einer Eigenschaft. Dies kann sich sowohl auf messbare Größen (zum Beispiel Anzahl, Umfang, Gewicht) als auch auf abstrakte Größen beziehen. In der Chemie ist Reduktion eine chemische Reaktionsart, bei der Elektronen aufgenommen und Oxidationszahlen somit verringert werden. Der Begriff Reduktion wurde in der Geschichte der Chemie ebenfalls unterschiedlich definiert:
Oxidation: Fe → Fe2+ + 2e- Reduktion: Cu2+ + 2e- → Cu Redoxgleichung: Fe + Cu2+ → Cu + Fe2+ Das ReduktionsmittelDas Reduktionsmittel ist dementsprechend der Stoff, der dem Reaktionspartner Elektronen zur Verfügung stellt: Er erniedrigt dessen Oxidationszahl. Es handelt sich also um einen Stoff, der andere Stoffe reduzieren kann und dabei selbst oxidiert wird (Elektronendonator) – also das Gegenteil zum Oxidationsmittel (Elektronenakzeptor). Gute Reduktionsmittel (Elektronendonatoren) sind:
Die Redoxreaktion: Elektronen-Übertragung durch Oxidation und ReduktionWenn bei einer Stoffumwandlung eine Elektronenübertragung stattfindet, heißt das, dass eine Elektronenabgabe (Oxidation) und eine Elektronenaufnahme (Reduktion) ablaufen: Der Stoff, der Elektronen abgibt, ist das Reduktionsmittel (Elektronendonator, seine Oxidationszahl steigt) - das Oxidationsmittel nimmt sie auf (Elektronenakzeptor, seine Oxidationszahl wird kleiner). Dieser Elektronenaustausch - zum Beispiel zwischen Ammonium- und Nitrationen im Düngemittel Ammoniumnitrat - kann bei falscher Handhabung unkontrolliert und explosionsartig verlaufen (siehe Abbildung):
Beispiele für verschiedene Arten von ElektronenaustauschSalzbildung: Reaktion von Metall und NichtmetallDie Elemente Magnesium und Iod bilden die Verbindung Magnesiumiodid 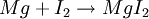 Magnesium gibt hierbei Elektronen an das Oxidationsmittel Iod ab. Zementation: Reaktion von Edelmetallkation und Metall
Die Stoffumwandlung von Aluminium und Kupfersulfat zu Kupfer und Aluminiumsulfat verläuft als Redoxreaktion, da Aluminium als Reduktionsmittel Elektronen an die Kupfer-II-kationen des blauen Salzes abgibt:
2 Al (s) + 3 CuSO4 Auf einem Zinkstab (als Reduktionsmittel), der in eine Lösung mit Kupfer-II-Ionen (Oxidationsmittel) taucht, scheidet sich ebenfalls elementares Kupfer ab (Zementation). Die Lösung wird mit Zink-II-Ionen angereichert. 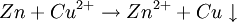 Redoxreaktionen lassen sich in die Teilreaktionen Oxidation und Reduktion zerlegen:
Auch die Amalgamprobe - eine Nachweisreaktion für Quecksilbersalze mit Kupferblech - ist eine Redoxreaktion. Diese „Zementation“ verläuft nach dem Schema:
Der Elektronendonator - hier das Metall Kupfer als Nachweismittel - ist das Reduktionsmittel: Es hat die Aufgabe, andere Stoffe zu reduzieren, wird jedoch selber oxidiert. Der Elektronenakzeptor - hier das in Lösung befindliche Quecksilbersalz - ist das Oxidationsmittel, da er andere Stoffe oxidiert und selber Elektronen aufnimmt (reduziert wird). Auch an diesem Beispiel zeigt sich: Bei jeder Oxidation werden Elektronen abgegeben, sodass die Oxidationszahl ansteigt. Umgekehrt wird bei der Reduktion die Oxidationszahl verkleinert (reduziert). Reaktion von Nichtmetall mit NichtmetallanionElementares Chlor setzt - bei einer Halogenid-Nachweisreaktion in Wasser gelöst - aus Natriumiodid elementares Iod frei und es bildet sich Natriumchlorid (Kochsalz):
Die Oxidationszahl des Oxidationsmittels Chlor wird hier kleiner (von 0 nach -1): Es wird reduziert. Iodid hingegen wird zu Iod oxidiert, welches sich dann rotviolett in Hexan löst (Abbildung). Ähnlich reagiert Chlorwasser auch mit Bromid (was dann ein durch Brom rotorange gefärbtes Hexan ergibt). Komproportionierung
Bei einer Komproportionierung (oder auch: Synproportionierung) reagieren Verbindungen, die ein Element in niedriger Oxidationstufe (Oxidationsmittel) enthalten, zusammen mit Verbindungen, in denen das betreffende Element in höherer Oxidationsstufe (Reduktionsmittel) vorliegt, zu einer Verbindung mit mittlerer Oxidationsstufe. Beispiel: Blei und Blei-IV-oxid reagieren in der Batteriesäure eines Bleiakkumulators beim Entladen zu Blei-II-sulfat (Autobatterie): Pb + PbO2 + 2 H2SO4 → 2 PbSO4 + 2 H2O DisproportionierungMan spricht von einer Disproportionierung, wenn bei einer chemischen Reaktion Elemente mit mittlerer Oxidationsstufe in solche mit einer niedrigen und einer höheren übergehen. Diese Reaktionen verlaufen häufig unter dem Einfluss eines Katalysators (Stoff, der eine chemische Reaktion beschleunigt, ohne sich dabei zu verändern) ab. Beispiel: Beim Erhitzen von Kaliumchlorat (Chlor mit Oxidationszahl +V) entsteht Sauerstoff, Kaliumchlorid (Chlor mit –I) und Kaliumperchlorat (Chlor mit +VII): 2 KClO3 → KClO4 + KCl + O2 (endotherme Reaktion) Reaktionsschemata bei RedoxreaktionenWie jede chemische Reaktion, so wird auch eine Redoxreaktion als Reaktionsschema geschrieben. Ein Beispiel für eine einfache anorganische Redoxgleichung (Reaktionsschema in Teilschritten, mit Oxidationszahlen) ist die Zementation von Kupfer aus Kupfer-II-salzlösung mit Eisen:
Kupfersalze oxidieren Eisen: Kupferionen nehmen Elektronen auf, Eisen gibt sie ab. Die Oxidationszahl des Kupfers wird also kleiner (von +2 nach 0), die des Reduktionsmittels größer (Fe von 0 nach +2). Oxidation: Reduktion: Formulierung von Redox-Reaktionsgleichungen
Solche zum Teil komplizierteren Reaktionsschemen formuliert man, falls nötig, über Koeffizienten oder – so ein zweites Beispiel - am Besten auch schrittweise. Für die Redoxreaktionen von Kaliumnitrat (Salpeter) mit Schwefel und von Kupfer mit konzentrierter Salpetersäure wird das Reaktionsschema zum Beispiel folgendermaßen erstellt: 1. Beispiel: Über Koeffizienten (richtig) Oxidationszahl und Elektronengleichung sind praktische Hilfsmittel, um vollständige Reaktionsgleichungen für Redoxreaktionen zu formulieren. Zunächst nehmen wir ein einfaches Beispiel: a KNO3 + b S → c K2SO4 + d NO Die Koeffizienten a, b, c und d lassen sich hier noch durch Vergleich der beiden Seiten des Reaktionsschemas bestimmen: 2KNO3 + S → K2SO4 + 2NO 2. Beispiel: In Teilschritten (mit „Elektronengleichungen“) Für die Gleichung, mit der wir die Reaktion zwischen Kupfer und unverdünnter Salpetersäure beschreiben, ist das erheblich schwerer: a Cu + b HNO3 → d Cu(NO3)2 + e H2O + f NO Zur Bestimmung der gesuchten Koeffizienten sind nacheinander folgende Schritte notwendig: - Zunächst müssen die bei der Reaktion auftretenden Teilchen formuliert werden: Cu + H+ + NO3- → Cu2+ + NO3- + H2O + NO - Dann schreibt man über jedes Elementsymbol die entsprechende Oxidationszahl: 0 +I +V-II +II +V-II +II-II +I-II
Cu + H+ + NO3- → Cu2+ NO3- + NO + H2O
- Die Teilchen der Ausgangs- und der Endstoffe werden verglichen. Man ermittelt dabei die Teilchen, bei denen sich die Oxidationszahlen geändert haben und formuliert die beiden Teilvorgänge: 0 +II
Cu → Cu2+ + 2e-
+V +II
NO3- + 3e- → NO
- Jetzt wird mit dieser Teilmenge mit dem kleinsten Faktor multipliziert, welcher bewirkt, dass die Zahl der aufgenommenen Elektronen gleich der Zahl der abgegebenen Elektronen wird: Teilvorgänge ohne Koeffizienten Faktoren Teilvorgänge mit Koeffizienten
Cu → Cu2+ + 2e- · 3 3Cu → 3Cu2+ + 6e-
NO3- + 3e- → NO · 2 2NO3- + 6e- → 2NO
____________________________________________________________________________
Für die beiden Teilvorgänge gilt also die Teilchengleichung:
3Cu + 2NO3- → 3Cu2+ + 2NO
- Nun stellt man die Zahl der Sauerstoffatome (mit der Oxidationzahl -II) auf beiden Seiten der Gleichung fest. Links ermittelt man 6, rechts 2 Sauerstoffatome. Auf der rechten Seite der Gleichung fehlen 4 Sauerstoffatome. Sie sind im H2O als weiterem Reaktionsprodukt enthalten. Zur Bildung von Wassermolekülen braucht man 8 Wasserstoffatome mit der Oxidationszahl +I, d.h. 8 H+-Ionen: 3Cu + 2NO3- + 8H+ → 3Cu2+ + 2NO + 4H2O Die vollständige Reaktionsgleichung lautet also: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O Kupfer-II-nitrat-Lösungen sind blaugrün gefärbt. Das Stickstoffmonoxidgas reagiert zu braunem Stickstoffdioxidgas bzw. Distickstofftetroxid weiter. Dieses wird in der Raketentechnik als Oxidationsmittel in Flüssigtreibstoffgemischen verwendet. Redoxvorgänge und ElektrochemieBei der räumlichen Trennung von Reduktion und Oxidation entsteht eine elektrochemische Zelle. Man unterscheidet elektrochemische Zellen, in denen die elektrochemische Reaktion (die Zellreaktion) freiwillig abläuft, diese Zellen nennt man galvanische Zellen. Wird die Zellreaktion durch das Anlegen eines Strom von außen erzwungen, damit die elektrochemische Reaktion abläuft, so spricht man von einer Elektrolysezelle. Die Elektrochemie ist das Teilgebiet der Physikalischen Chemie, welches sich mit dem Zusammenhang zwischen elektrischen und chemischen Vorgängen befasst. Wenn daher eine Redoxreaktion durch einen elektrischen Strom erzwungen wird oder einen solchen liefert, so ist dies ein elektrochemischer Vorgang. Galvanische Elemente, Akkumulatoren und Elektrolyse
Wird die Redoxreaktion durch eine von außen angelegte elektrische Spannung erzwungen, so nennt man diesen Vorgang (Elektrolyse) - wird durch die chemische Reaktion geeigneter Substanzen eine messbare Spannung hervorgerufen, so liegt ein galvanisches Element vor. Diese Spannungen (Redoxpotentiale) sind charakteristisch für die jeweiligen Reaktionen und sind auf einer Skala dokumentiert, der elektrochemischen Spannungsreihe. Hier wird also die Stärke eines Oxidations- oder Reduktionsmittels messbar. Elektrochemische Redoxreaktionen laufen in einer galvanischen Zelle ab:
Die für die Elektrochemie entscheidenden Vorgänge laufen dabei an der Phasengrenze Elektrode-Elektrolyt ab - Elektrochemie ist also die Wissenschaft der Vorgänge an der Phasengrenze zwischen einem Elektronenleiter (Elektrode) und einem Ionenleiter (Elektrolyt). Anwendungen der Elektrochemie
Literatur
Kategorien: Nachweisreaktion | Chemische Reaktion |
|
| Dieser Artikel basiert auf dem Artikel Redoxreaktion aus der freien Enzyklopädie Wikipedia und steht unter der GNU-Lizenz für freie Dokumentation. In der Wikipedia ist eine Liste der Autoren verfügbar. |


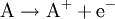
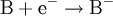
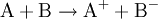


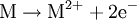

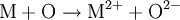
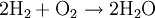
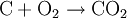
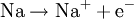
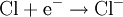
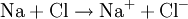
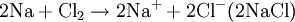
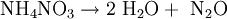
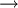 Al2(SO4)3 (aq) + 3 Cu (s)
Al2(SO4)3 (aq) + 3 Cu (s)
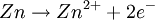
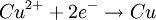
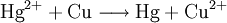
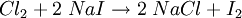
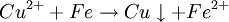
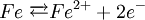
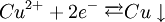 _____________________________________
Redox.:
_____________________________________
Redox.: 

